Maladie infectieuse émergente
| Causes | Zoonose |
|---|
| Spécialité | Infectiologie, épidémiologie et santé publique |
|---|
| CIM-10 | B99.0 |
|---|---|
| CIM-9 | 136 |
| MeSH | D021821 |
Une maladie infectieuse émergente est une maladie causée par un agent infectieux (d'origine bactérienne, virale, parasitaire, fongique ou un prion) ou présumée telle, inattendue, affectant l'humain ou l'animal ou les deux. Elle est inattendue parce qu'elle est réellement nouvelle (nouvel agent infectieux), ou parce que son identification est récente (nouvelle capacité à faire le diagnostic), ou parce que son agent infectieux s'est modifié en acquérant de nouvelles caractéristiques (nouvelle expression clinique ou épidémiologique, gravité modifiée, résistances aux traitements, etc.), ou parce qu'elle a été oubliée et que sa réapparition est inattendue (réémergence). Au XXe siècle, après des décennies pendant lesquelles on a cru fermement à la disparition prochaine des maladies infectieuses du fait de la découverte de vaccins et médicaments très efficaces soutenus par des politiques extensives d'amélioration de l'hygiène individuelle et collective, le dernier quart du siècle a au contraire dû admettre que de nouvelles maladies infectieuses (ou nouvelles formes de ces maladies) étaient inévitables, comme le prédisait Charles Nicolle dès 1933.

Historique
[modifier | modifier le code]Préambule
[modifier | modifier le code]Charles Nicolle, Prix Nobel de physiologie et de médecine en 1928, déclarait dans sa seconde année d'enseignement au Collège de France « Il y aura des maladies infectieuses nouvelles. C'est un fait fatal... nous ne saurons jamais les dépister dès leur origine... Il faut aussi bien se résigner à l'ignorance des premiers cas évidents... et ce n'est qu'après une longue période de tâtonnements qu'on dégagera le nouveau type pathologique... Pour qu'on la reconnaisse plus vite, il faudrait que l'infection nouvelle soit d'importation exotique et douée d'un pouvoir marqué de contagiosité, telle autrefois la syphilis à son débarquement en Europe[1] ».

Entre 1940 et 2004, environ 335 émergences infectieuses ont été recensées, en particulier dans les années 1980 où la plupart du temps ces émergences étaient associées à la pandémie de sida [2]. Dans la majorité des cas, ce ne sont pas des virus mais des bactéries, et notamment des bactéries pharmaco-résistantes (en nombre croissant dans les pays développés) qui sont à l’origine de ces maladies elles-mêmes souvent d’origine animale (à plus de 52%). La progression des maladies à vecteur (transmises par des moustiques, vers, tiques, etc.) laisse apercevoir la très grande vulnérabilité aux bouleversements climatiques des pays à revenus faibles ou moyens[2]. Vers la fin du XXe siècle on affirme que ce retour inquiétant des maladies infectieuses était parfaitement prévisible. Les microbes ne cessent-ils pas d’évoluer sous l’effet même des transformations sociales et écologiques induites par les activités humaines : modifications de la composition démographique des sociétés, pratiques agricoles, désordres politiques et sociaux, croissance économique, développement exponentiel des transports intercontinentaux, effets iatrogènes des nouvelles technologies médicopharmaceutiques ? Le vieillissement de la population ne peut en outre que s’accompagner d’une augmentation de la morbidité infectieuse, les personnes âgées étant particulièrement susceptibles. Mais si pareille doctrine semble bien établie en 1997, il n’en est pas ainsi dix ans plus tôt[3].
Naissance d'une doctrine
[modifier | modifier le code]Son lancement est le fait d’un jeune virologiste américain, Stephen S. Morse (en). En compagnie de Joshua Lederberg et d’Edwin D. Kilbourne (en), et avec le soutien du National Institute of Allergy and Infectious Diseases (NIAID) et de l’Université Rockefeller à laquelle il était rattaché, Morse organise et préside, en , à Washington (DC), une conférence intitulée Emerging Viruses dont les débats vont tracer un profond sillon[4],[Note 1]. Dans son exposé, il livre les grandes lignes d’une explication possible des mécanismes à l’origine de l’émergence de « nouveaux » virus (lesquels ne représentent néanmoins qu’un quart environ des émergences constatées au cours de la période mentionnée ci-dessus). Il propose d'appeler virus émergents soit des virus récemment apparus dans la population, soit des virus qui se sont rapidement disséminés, entraînant une augmentation corrélative de la morbidité. Ces émergences n’ont rien d’un phénomène temporaire. Au contraire, leur fréquence ne pourra que s’accélérer à mesure que les modifications de l’environnement elles-mêmes iront s’amplifiant[8].
La naissance du concept de maladie émergente est toutefois légèrement antérieure à la Conférence de Washington[3]. Morse a rappelé ses discussions avec Mirko Grmek, l’auteur d’une Histoire du sida parue en 1989[9]. Si dans cet ouvrage Grmek critique l’expression de maladie nouvelle due à Charles Nicolle[1], expression selon lui imprécise, il ne lui reconnait pas moins le mérite de soulever le problème de l’émergence tant au point de vue gnoséologique (une entité nosologique apparaît au moment où l’on dispose d’un outil intellectuel capable de la nommer et de la définir) qu’au point de vue de la connectivité spatiale (choléra) ou de l’évolution génétique, voire à celui des effets indésirables de la civilisation (légionellose, fièvres hémorragiques en Afrique)[10],[Note 2]. Plus généralement, Grmek définit dans son ouvrage une demi-douzaine de situations historiques pouvant rendre compte de l’émergence : émergence de connaissance, augmentation brutale de l’incidence d’une maladie, dissémination d’un germe dans une nouvelle région du monde, franchissement de la barrière d’espèce, évolution virale, nouveauté vraie (manipulations biotechnologiques). Ces situations historiques préfigurent en tout point les facteurs d’émergence chers à Stephen Morse[Note 3]. Ainsi les « maladies nouvelles », héritage de Charles Anglada[14], de Charles Nicolle et de Max. Sorre[15], semblent donner d’avance la main aux maladies émergentes.
Réticence française
[modifier | modifier le code]Or, en France, la philosophie des sciences privilégie l’émergence de connaissance, qu’elle distingue alors de l’émergence écologique[16]. En 1995, dans la postface à la troisième édition de son Histoire du sida, substituant l’idée de maladie émergente (Morse) à celle de maladie nouvelle (Nicolle), Grmek définit pourtant la maladie émergente comme « existante dans la population avant d’être conceptualisée comme entité nosologique »[17]. La notion d’émergence de connaissance demeure néanmoins le sens premier chez les virologistes français, même si ceux-ci, à partir de 2005, reconnaissent la réalité de l’émergence vraie[18]. En France, l’essence de la nouveauté reste donc longtemps principalement discursive, c’est-à-dire limitée au champ sémantique avec ses concepts[19].
Place des historiens
[modifier | modifier le code]La théorie de l’émergence des maladies « nouvelles » propose une interprétation de l’histoire des maladies infectieuses. La fonction de l’histoire dans l’étude des virus émergents est appelée par l’ontologie de la doctrine, c’est-à-dire l’interdépendance fondamentale entre le microbe et l’hôte, « l’essence même du virus » selon la formule de Joshua Lederberg[20]. Lorsque l’hôte est humain, les facteurs sociaux jouent un rôle considérable. Il en découle que l’histoire collabore étroitement avec la biomédecine pour la compréhension des émergences virales. Morse insiste à plusieurs reprises sur l’idée que l’histoire permet de comprendre les formes et les modalités de la circulation microbienne. Dans l’histoire des pestes, par exemple, marchands, armées, pèlerins, tout ce qui marche et tout ce qui roule, tout ce qui navigue aussi, dissémine rats et puces en colportant marchandises, vêtements et grains[21].
Il n’est donc pas étonnant que le petit noyau fondateur de la doctrine rassemble des biologistes (S. Morse, J. Lederberg, F. Fenner, E. D. Kilbourne, L. Montagnier, D. A. Henderson) et des historiens (M. Grmek, Fernand Braudel, D. Fox et W. H. McNeill)[9].
Histoire cyclique, dont l’idée n’est pas neuve pour les virologistes mais qui a pris une actualité toute nouvelle avec l’hypothèse, relancée par Edwin D. Kilbourne en 1976, d’un cycle décennal de la grippe [22]. Trois ans plus tard, dans le premier volume de sa Civilisation matérielle, Fernand Braudel se saisit de la théorie cyclique des épidémies en s’inspirant de l’ouvrage de William McNeill, Plagues and Peoples, paru aux États-Unis l’année même où Kilbourne lance son cri d’alarme[23]. Elle figure en tête des Emerging Infectious Diseases, la revue lancée spécialement par les Centers for Diseases Control and Prevention (CDC) en 1995 pour institutionnaliser et enraciner le concept de maladie émergente dans l’administration américaine de la santé publique[24],[Note 4].
Si de nos jours l’idée d’un cycle décennal de la grippe pandémique est abandonné[25], le concept cyclique d’une histoire des pathologies infectieuses est néanmoins bien implanté dans l’historiographie. Comme le note Kilbourne à la fin de la conférence de 1989, on ne saurait mieux décrire la relation entre l’hôte et le microbe qu’en reprenant une formule de William McNeill de « conservation des catastrophes », par laquelle l’historien des épidémies considère que l’humain passe sans cesse d’un état de vulnérabilité à un autre[26],[Note 5].
Place des sciences sociales
[modifier | modifier le code]Les deux idées parentes d’une histoire cyclique des maladies et de la causalité anthropique des infections (comme l’écrit Morse « nous sommes tous des ingénieurs de la circulation microbienne » [28]), labourent en profondeur l’ontologie du monde microbien. Toutefois, si Français et Américains s’accordent pour considérer l’émergence comme un mode de la connaissance, chez les uns et les autres l’idée d’émergence n’entretient pas un même rapport à la causalité. Pour Stephen Morse, les causes des épidémies ont pour origine des modifications de la circulation microbienne, modifications qui, pour la plupart, sont d’origine humaine. L’émergence est le produit d’un acte, d’un acte humain. Pour Gessain et Manuguerra, par contre, parce que les premiers contacts entre l’humain et l’agent infectieux aboutissent très souvent à l’élimination du microbe par le système immunitaire ; parce que la persistance de l’infection chez l’hôte, signalant une possible émergence est un fait rare ; parce qu’encore plus rarement la dissémination de l’agent dans une nouvelle population sanctionne une émergence réussie, les activités humaines sont moins une cause à proprement parler qu’une occasion de l’émergence des maladies, une causalité, sans doute, mais adjacente et, pour tout dire, secondaire [29],[Note 6]. Ainsi pour Morse, l’humain fait émerger de nouveaux virus tandis que pour Gessain et Manuguerra, il laisse émerger des virus jusque-là inconnus. Dans cette dernière approche l’histoire sociale n’est au mieux que tangente à l’histoire naturelle. Lors de la conférence de 1989, Joshua Lederberg a prévu les résistances intellectuelles qui s’opposent à la doctrine des maladies émergentes. En effet l’idée de nouveaux virus porte en elle une menace effrayante, celle d’une nature qui ne serait pas nécessairement bénigne[31]. De là, peut-être, les réticences françaises. Aujourd’hui, en Amérique, les sciences sociales ont peut-être cessé d’être les voyageuses de la banquette arrière ; en France aussi, non sans qu’il ait fallu plus longtemps avant que le qualificatif de « sociales » cesse d’être péjoratif[HCSP 1],[32],[33].
Quelques définitions
[modifier | modifier le code]Émergence
[modifier | modifier le code]En français le concept d'émergence est utilisé dans plusieurs champs de la connaissance (philosophie, économie, zoologie, botanique, anatomie, physique, géologie). Dans le domaine médical il apparaît en anatomie au XIXe siècle pour décrire le point de sortie, d'apparition, d'un nerf à la surface du cerveau ou de la moelle épinière. En physique il désigne la sortie d'un rayonnement hors d'un milieu[34]. On retiendra le principe d'apparition et de soudaineté d'un phénomène [35]. Dans l'histoire récente du concept d'émergence en médecine il faut citer encore le débat entre les tenants de l'émergence de connaissances qui s'opposent aux tenants de l'émergence de maladies (ou émergence vraie), c'est cette dernière qui s'imposera progressivement[HCSP 2].
Dans la théorie des systèmes complexes, l'émergence est un concept qui peut être grossièrement résumé par l'adage : « le tout est plus que la somme de ses parties ».
Réémergence
[modifier | modifier le code]Anglicisme construit à partir de reemergence dont la traduction littérale est réapparition, résurgence. Encyclopædia Universalis donne comme définition : réapparition d'un phénomène disparu, oublié[36]. En santé publique il semble se limiter à la traduction littérale sans mention d'oubli préalable[HCSP 3].
Maladie émergente
[modifier | modifier le code]Une maladie émergente peut être une maladie nouvellement identifiée, ou une maladie anciennement connue mais nouvellement modifiée. Dans le premier cas elle se caractérise par son apparition souvent brutale, une augmentation de l'incidence dans le temps et/ou l'espace, une incertitude concernant l'ampleur du phénomène. Dans le second cas, l'émergence se caractérise aussi par une expression clinique et des conditions d'expansion modifiées[HCSP 3]. Elle n’est pas nécessairement infectieuse (ou pas encore reconnue comme telle).
Maladie infectieuse émergente
[modifier | modifier le code]
Une maladie infectieuse émergente (MIE) est une maladie due à un agent, de l'un des quatre groupes d'agents infectieux (bactéries, virus, parasites, agents fongiques) auxquels on ajoute les prions[HCSP 4], qui est inattendue en référence aux propriétés intrinsèques ou à la connaissance que l'on a de la biologie de son agent responsable, touchant l'humain, l'animal ou les deux[HCSP 3]. Dans la définition adoptée par la Cellule permanente des maladies infectieuses émergentes (CP-MIE) mise en place en France sous l’égide du Ministère de la Recherche en 2006 on retient de plus qu'« il peut s’agir d’une entité clinique d’origine infectieuse nouvellement apparue ou identifiée, d’une entité pathologique infectieuse connue dont l’incidence augmente dans un espace ou dans un groupe de population donné ou d’une modification qualitative et/ou quantitative des caractéristiques de l’agent, de la maladie ou de la population touchée et de son environnement. Dans une optique d’anticipation, il peut s’agir d’une maladie identifiée dont les conditions d’expression deviennent favorables. Habituellement, une incertitude réelle ou perçue quant au potentiel évolutif, quant à la maîtrise du phénomène et de son impact en santé publique humaine et/ou animale, est présente »[37].
Maladie infectieuse liée à un risque épidémique et biologique (REB)
[modifier | modifier le code]L'élaboration progressive du concept d'émergence dans les années 1990 s'est vue complétée dans les années 2000 par l'irruption sur la scène politique et sanitaire du risque biologique, en particulier du risque biologique provoqué, à la suite de la crise provoquée par les enveloppes contaminées au bacille du charbon survenue aux États-Unis après les attentats du 11 septembre 2001. Dès lors le risque ou l'émergence d'une maladie infectieuse peut aussi être compris comme une menace politico-militaire créant un pont entre préoccupations de santé publique et de sécurité nationale[HCSP 5],[38].
Exemples illustratifs d'émergences et réémergences
[modifier | modifier le code]Plus de 50 nouveaux agents responsables de maladies chez l'humain ont été identifiés depuis 1975[39],[HCSP 6]. Il ne s'agit pas dans cet article de toutes les présenter, des articles spécifiques étant développés. Les listes de MIE évoluent chaque année et certains établissements de recherche en entretiennent une comme le National Institute of Allergy and Infectious Diseases aux États-Unis que le lecteur pourra consulter régulièrement[40]. De plus, il ne faut pas oublier que 60 % des maladies émergentes ou réémergentes sont d'origine virale. Parmi les seuls évènements sanitaires survenus depuis le début du XXIe siècle, quelques maladies présentées brièvement ci-après illustrent divers types d'émergences et les différentes réponses apportées.
Nouvelles coronaviroses
[modifier | modifier le code]
Maladie à coronavirus 2019
[modifier | modifier le code]En , un nouveau coronavirus émerge en Chine dans la ville de Wuhan de la province de Hubei, il est dénommé coronavirus du syndrome respiratoire aigu sévère 2, ou SARS-CoV-2. Il est à l'origine de l'épidémie de coronavirus de 2019-2020 de la forme de pneumonie dénommée maladie à coronavirus 2019 (Covid-19). Celle-ci est déclarée urgence de santé publique de portée internationale par l'Organisation mondiale de la santé (OMS) le [41]. Il a d'abord été désigné provisoirement par l'OMS[42] sous le terme anglais 2019 novel coronavirus, avant d'être nommé SARS-CoV-2 sur recommandation du Comité international de taxonomie des virus (ICTV)[43]. Le , l'OMS reclasse l'épidémie de Covid-19 comme étant une pandémie[44].
Syndrome respiratoire aigu sévère (SRAS)
[modifier | modifier le code]Le SRAS correspond à l'émergence d'un nouveau virus, le SARS-CoV, un coronavirus apparu en novembre 2002 dans la province de Guangdong, en Chine et se diffusant en une seule vague (de au ) au niveau de la planète, disparaissant ensuite sans explication. Il est responsable d'une forte mortalité humaine (774 décès pour environ 8 000 malades dans 33 pays) et a justifié une prise de précautions maximales. Il a d'abord fallu reconnaître que les humains étaient confrontés à une maladie inconnue, la décrire et comprendre son mode de transmission pour pouvoir proposer et mettre en place des mesures de contrôle (isolement des patients, quarantaine des contacts), découvrir son agent responsable et inventer la méthode d'identification diagnostique de celui-ci. La coordination internationale de la réponse a pu permettre de limiter l'extension de l'épidémie et aussi les caractéristiques cliniques de cette maladie (pas de forme bénigne c'est-à-dire tous les malades se retrouvaient à l’hôpital et contagieux 3 à 4 jours après l'apparition des signes cliniques)[HCSP 7].
Virus du Nil occidental aux États-Unis
[modifier | modifier le code]Article détaillé Virus du Nil occidental aux États-Unis (en)
Le virus du Nil occidental est un virus aviaire transmis par les moustiques du genre culex. Le culex transmet ce virus aux équidés et à l'humain. Environ 70 % des personnes contaminées ne présentent aucun signe clinique, les autres un syndrome grippal et seulement 1 % développent une encéphalite.
L'émergence en 1999 de ce virus aux États-Unis, est un bon exemple d'une maladie connue qui émerge dans un pays indemne, du fait du développement des voyages intercontinentaux, suivie d'une diffusion à tout un continent. Introduit dans l'État de New York en 1999, le virus trouve sur le territoire nord-américain un écosystème favorable avec la présence d'oiseaux réceptifs[Note 7] qui constituent rapidement un énorme réservoir et de plusieurs espèces de moustiques aptes à remplir le rôle de vecteur. Plus de 4 000 cas humains sont déplorés dès 2002 et près de 10 000 cas en 2003 tandis que la quasi-totalité des états sont touchés ainsi que le Canada et à un moindre degré le Mexique[46],[HCSP 8]. La maladie étant connue comme grave (elle peut provoquer une encéphalite mortelle), elle est donc d'emblée redoutée et génère des décisions politiques immédiates[47].
Entre 1999 et 2010 on estime que 3 millions de personnes ont été infectées aux États-Unis. Les incidences les plus élevées ont été observées dans les états des grandes plaines centrales[48]. La série de cartes qui suivent montrent la progression du nombre de patients à travers les États-Unis entre 1999 et 2005. La couleur de chaque état correspond au pourcentage de l'ensemble des cas survenu dans l'état dans l'année par rapport au total du pays. Zéro pour cent (0 cas) en blanc, moins de 1 % en bleu, entre 1 et 5 % en vert, entre 5 et 10 % en jaune, et plus de 10 % des cas de l'année en rouge.
-
1999
-
2000
-
2001
-
2002
-
2003
-
2004
-
2005
Zika
[modifier | modifier le code]Le virus Zika a été découvert de façon accidentelle en 1947 en Ouganda chez des singes rhésus captifs dans la forêt de Zika[49]. Sa récente diffusion est celle d'une émergence en plusieurs temps, avec aggravation successive de l'impact sanitaire.

La première patiente est diagnostiquée au Nigeria en 1954, elle souffre de fièvre et de maux de tête. En 20 ans seulement trois cas humains, tous bénins, seront reconnus en Afrique. Jusqu’en 2002, seulement 10 souches de virus sont isolées chez l’humain, mais le virus est retrouvé chez de nombreuses espèces animales dans toute l’Afrique et l’Asie jusqu’en Indonésie. En 2007, une première émergence d'ampleur épidémique est décrite à Yap, une île de 7 500 habitants des États fédérés de Micronésie. Une cinquantaine de cas bénins sont recensés, aucun patient n’est hospitalisé, mais 73 % de la population a été infectée. À ce stade la maladie émerge sans prendre d’aspect inattendu[49]. En , le virus émerge de nouveau, cette fois en Polynésie française. En 5 mois on estime que 28 000 personnes sont atteintes, soit 11 % de la population. Cette fois des formes sévères de la maladie sont pour la première fois observées, particulièrement neurologiques, dont le syndrome de Guillain-Barré et surtout dès le les premiers cas groupés de microcéphalies chez des nouveau-nés dont les mères n'avaient pourtant pas présenté de signes de maladie pendant leur grossesse. En la circulation du virus Zika est confirmée au Brésil, dès juillet le lien avec le syndrome de Guillain-Barré y est confirmé, dès octobre l'augmentation des microcéphalies est évidente[49]. En , constatant la diffusion de la maladie et de ses conséquences aux Amériques, l'Organisation mondiale de la santé en fait une « urgence de santé publique de portée internationale ». En 2017, le risque de survenue d'une microcéphalie du nouveau-né dont la mère a été infectée pendant la grossesse est estimée entre 2 et 3 %[50],[51].
Chikungunya
[modifier | modifier le code]
L'émergence en 2006 à La Réunion de la fièvre à virus Chikungunya, virus réputé jusqu'alors ne conférer qu'une maladie bénigne, correspond à l'émergence dans un territoire indemne, de formes inconnues d'une maladie connue. Faussement rassurée par le caractère historiquement bénin de la maladie et handicapée par l'absence de test de diagnostic disponible dans les laboratoires d'analyses médicales de proximité[HCSP 9], la réponse collective à l'émergence est insuffisante, longtemps non coordonnée et finalement génératrice d'une crise sanitaire, sociale et politique[52]. À l'origine de cette émergence on retrouve les voyages internationaux qui ont permis l'introduction dans l’île d'un virus jusque-là absent, suivie après quelques mois d'une simple mutation du génome du virus portant sur un seul acide aminé. Cette mutation a octroyé au moustique, localement vecteur, une capacité de production de virus 100 fois plus importante qu'auparavant et donc un pouvoir de dissémination tout à coup énorme[53]. Cliniquement, la grande nouveauté de cette émergence est la découverte des formes graves, voire mortelles, de la maladie que ce soit les formes rhumatismales aigües, subaigües et chroniques, les aspects cardiaques et vasculaires, les complications de maladies préexistantes et l'impact à long terme sur la qualité de vie des patients (d'autant plus importante que d'âges avancés)[54],[55],[56]. La proportion des formes graves de la maladie n'a probablement pas augmenté. Mais elles étaient jusque-là ignorées dans les toutes petites épidémies historiques (quelques dizaines à centaines de patients), et sont devenues évidentes au sein d'une épidémie de plusieurs centaines de milliers de malades[52].
Fièvre catarrhale ovine
[modifier | modifier le code]
La fièvre catarrhale ovine (FCO, en anglais Blue tongue) est une maladie virale transmise d'un animal infecté à un autre par la piqûre d'un moucheron du genre Culicoides. Affectant surtout les moutons, elle peut affecter les bovins, les chèvres et d'autres ruminants sauvages. Il s'agit d'une maladie strictement animale. Initialement présente en Afrique, la FCO s’est étendue vers le Nord depuis quelques décennies, extension probablement liée au réchauffement climatique et aux échanges commerciaux. En effet, la transmission de cette maladie est liée à la présence des populations de culicoïdes, qui jouent le rôle de vecteurs et dont le développement est favorisé par des températures élevées. La maladie est dorénavant présente sur tous les continents[57].
En 2006, une épizootie de FCO provoquée par une souche non répertoriée de sérotype 8 (ou BTV-8, pour bluetongue virus) a affecté pour la première fois l'Europe du Nord-Ouest. Cinq pays sont atteints en 2006, l'Allemagne, la Belgique, la France, le Luxembourg et les Pays-Bas, affectant environ 2 000 foyers. À partir de juillet 2007, l'épizootie reprend et plus de 50 000 foyers à BTV-8 sont recensés atteignant de plus la Suisse, la République Tchèque et le Royaume-Uni[57]. Parallèlement aux mesures sanitaires mises en place, des campagnes de vaccination obligatoire du cheptel ont été instaurées sur le territoire continental français du printemps 2008 jusqu’à l’automne 2010. L’impact de la vaccination et de l’acquisition d’une immunité protectrice à la suite d’une infection s’est traduit par un effondrement du nombre de foyers : moins d’une centaine en 2009 en France, un seul en 2010, aucun en 2011. La situation sanitaire s’est progressivement améliorée dans toute l'Europe du Nord (le Royaume-Uni est indemne de FCO en 2011, l’Allemagne, la Belgique et les Pays-Bas en 2012)[57].
Après quelques années sans détection en France continentale, cette souche de BTV-8 a toutefois réémergé dans l’Allier en 2015[57]. Cette réémergence a été suivie par l’introduction à partir de la Sardaigne d’une souche de BTV-4 en Corse en 2016 qui a touché l’année suivante la France continentale [58]. Les sérotypes 4 et 8 sont considérés aujourd'hui comme enzootiques en France métropolitaine.
Grippe pandémique A(H1N1) de 2009
[modifier | modifier le code]
Responsable de la grippe espagnole, le virus A(H1N1) est réapparu en 2009 et représente un cas d'émergence d'un nouveau variant de virus connu, provoquant une pandémie mondiale. L’Organisation mondiale de la santé (OMS) déclenche le une alerte mondiale sur l'apparition de cas humains de grippe porcine au Mexique, marquant le début d'une crise sanitaire[59]. À cette date, 9 pays sont touchés ; ils sont 129 au . Le , l'OMS requalifie l'épidémie de grippe A(H1N1) en phase 6 de son échelle de gravité, c'est-à-dire au stade de pandémie. Au mois de mai, les données en provenance du Mexique évoquent un taux d’attaque[60] et une létalité supérieure à ceux de la grippe saisonnière. Ces éléments ne sont toutefois pas confirmés et, dès le mois de juin, il apparaît que la majorité des cas sont bénins, avec une létalité globale du même ordre que celle d’une grippe saisonnière. Deux éléments restent cependant préoccupants : les femmes enceintes et les adultes de moins de 65 ans sont touchés par des formes beaucoup plus graves que celles de la grippe saisonnière. Il reste possible qu’avec une létalité identique à celle d’une grippe saisonnière s’appliquant à un taux d’attaque important on subisse un nombre très important de décès au sein de ces populations jeunes. L'augmentation de l'incidence qui caractérise le début de l'épidémie apparaît précocement par rapport à la grippe saisonnière (par exemple, dès septembre en France) mais la perception de la gravité décroit nettement[59]. Le risque de mutation du virus à tout moment constitue néanmoins un sujet de préoccupation. En France le pic épidémique est atteint la première semaine de décembre et la décroissance est manifeste dès la fin du mois[59]. Un an après le déclenchement de l'alerte par l'OMS, 213 pays et territoires ont été touchés. Le taux d'incidence global de la pandémie mesuré par le taux de séroconversion, tous âges confondus, est estimé entre 20 et 27 % de la population[61] ; le nombre de décès confirmés, dans le monde entier, par un laboratoire était de 18 500 morts mais compte tenu du faible accès au diagnostic virologique, une étude globale de la mortalité a estimé celle-ci dans une fourchette allant de 151 700 à 575 400 morts[62]. Parmi les stratégies opposables à la progression de la pandémie, la protection de la population par la vaccination généralisée a été l'objet de véritables enjeux et finalement de crises politiques du fait des coûts induits, des délais de fabrication et de mise à disponibilité, des lois de l'économie, de l'étroitesse de l'offre industrielle, des choix de stratégie de distribution et réalisation des actes vaccinaux[63],[64],[65].
Ebola en Afrique de l'Ouest
[modifier | modifier le code]L'épidémie de maladie à virus Ebola (MVE), qui a touché l'Afrique de l'Ouest à partir de 2013, illustre les effets catastrophiques de l'émergence d'un virus pourtant connu, dans un contexte urbain de sous-développement, de désorganisation et d'impréparation. Elle a sévi principalement en Guinée, au Libéria et en Sierra Leone, de à . Elle est la plus importante jamais observée depuis la découverte du virus en 1976 au Zaïre (devenue République démocratique du Congo, RDC)[66]. La MVE a un très mauvais pronostic chez l'humain, jusqu'à 90 % de malades décèdent en l'absence de prise en charge médicale rapide, et chez les grands primates non humains d'Afrique (chimpanzés, gorilles)[66],[67].
Le cas index, un garçon de 18 mois décédé, est survenu en dans le village de Méliandou, en Guinée forestière, situé à 10 km de Guéckédou, chef-lieu de préfecture, lui-même à 5 km de la frontière libérienne. L'enfant se serait contaminé au contact de chauves-souris dont une colonie résidait dans l'émousse d’un vieil arbre [68],[69],[70],[71]. Plusieurs membres de la famille de ce premier cas décèdent les jours suivants dans un tableau infectieux similaire avec fièvre, troubles digestifs et hémorragies[69].
Après son émergence l'infection se répand à bas bruit en Guinée forestière sans que la MVE ne soit suspectée. Les chefs-lieux de préfecture Guéckédou, Macenta et Kissidougou, sont atteints en . L'alerte nationale est lancée le après le décès suspect de plusieurs professionnels de santé de l'hôpital de Macenta. La capitale guinéenne Conakry est atteinte le . Le virus Ebola est isolé le sur des échantillons de sang de malades par le laboratoire P4 Mérieux-Inserm de Lyon (laboratoire de niveau de sécurité maximal). La souche virale isolée est un variant de l'espèce Ebola-Zaïre, dénommé Makona (EBOV-Mak), en référence à la rivière frontalière avec la Sierra Leone et le Libéria proche de la zone d'émergence[68]. Ce virus variant serait apparu en 2004 d'un ancêtre commun avec un virus de l'espèce Ebola-Zaïre de la RDC. L'épidémie guinéenne serait issue d'une transmission unique à partir d'un réservoir animal[72].
L'épidémie s'étend au Libéria dans le comté de Lofa, frontalier de Guéckédou, où le premier cas est confirmé le . Fin avril le district de Kailahun en Sierra Leone, également frontalier de Guéckédou, est atteint. Le premier cas y est une guérisseuse traditionnelle décédée après avoir donné des soins à des malades guinéens atteints d'Ebola. Ses funérailles non sécurisées sont célébrées en présence de centaines de participants. La confirmation officielle de la MVE n'est faite que le 25 mai, un mois après l'introduction du virus dans le pays. Monrovia, capitale du Libéria, est atteinte en mai et Freetown, capitale de la Sierra Leone, en juin[70],[73].
Le nombre de cas va ensuite exploser, passant de 650 nouveaux cas pour les trois pays en juillet à 3 500 en septembre, avec son cortège de résistances dans des populations ayant peur, ne comprenant pas cette maladie inconnue dans cette région et doutant de son existence. Ces résistances sont favorisées par l'inadaptation de la communication pour l'engagement communautaire, à l'origine de multiples agressions des équipes de riposte et le refus des stratégies de lutte que sont : le transfert et l'isolement des malades suspects, les enterrements dignes et sécurisés (EDS) et le suivi des personnes contacts des malades et des décédés de MVE. Le message initial déclarant qu'il n’existait ni traitement ni vaccin contre le virus Ebola n'était pas porteur d'espoir et ne favorisait pas la participation des populations à la lutte, de même que l'interdiction de la consommation de la viande de brousse, importante source locale de revenus, et celle des rituels funéraires sans diagnostic préalable des sujets décédés[74]. Des manifestations violentes éclatent à Monrovia dans le quartier de West Point mis en quarantaine par les autorités en réaction à l'attaque d'un centre d'isolement, et tentant de contrôler l'épidémie qui flambe dans la capitale « avec des morts abandonnés dans les rues »[70],[75]. Ces réticences communautaires atteignent leur paroxysme dans la localité de Womey en Guinée forestière où elles font 8 victimes en septembre[76],[77].
L'Organisation mondiale de la santé (OMS) déclare qu'Ebola est une « urgence de santé publique de portée internationale » (USPPI) le . À partir de cette date la mobilisation internationale se met en œuvre. Les Nations-Unies adoptent des résolutions pour lutter contre cette épidémie et créent une mission spéciale (UN Mission for Ebola Emergency Response [UNMEER]) pour coordonner les agences onusiennes[78]. Les États-Unis pour le Libéria, la France pour la Guinée et le Royaume-Uni pour la Sierra Leone élaborent des plans d'action pour venir en aide à ces pays. À compter d'octobre le renforcement des moyens financiers, humains et matériels est massif. Ainsi les nombres de centres de traitement Ebola (CTE) et de laboratoires de diagnostic, respectivement de 16 et 11 en octobre, vont fortement augmenter en nombre pour atteindre 42 CTE et 26 laboratoires en [70]. Les Nations-Unies estiment les fonds engagés pour la lutte contre Ebola par les partenaires à environ 3 milliards de dollars américains[79].
Ce renforcement de la riposte porte ses fruits dès où l'on constate une baisse de près de 80 % de l’incidence de la maladie, qui passe de 4 000 nouveaux cas pour le seul mois de novembre pour les trois pays à un peu moins de 900 en janvier[80]. En débute en Guinée, sous l'égide de l’OMS, un essai clinique avec le candidat vaccin recombinant (vaccin /rVSV-GP-ZEBOV) des laboratoires Merck Sharpe & Dohme. Les résultats préliminaires en montrent une bonne tolérance et une efficacité vaccinale au dixième jour, chez les sujets contacts vaccinés immédiatement après l'exposition au virus [81],[82],[83]. Les derniers cas surviennent en en Guinée forestière, dont trois se réfugient à Monrovia[84]. Après une période de surveillance renforcée de 19 semaines (deux fois l'incubation maximale de l'infection soit 42 jours plus 90 jours), l'épidémie prend fin officiellement en Sierra Leone mi-, en Guinée fin et au Libéria début [70].

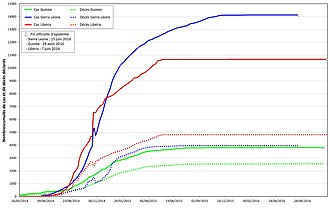
Le bilan final de l'épidémie, sans doute sous-évalué, est de 28 652 cas notifiés dont 53 % confirmés biologiquement. La létalité est égale à 39,5 %. Les personnes sorties guéries des CTE sont plus de 17 000 et les orphelins d'Ebola environ 22 000.
Les professionnels de santé ont payé un lourd tribut à l’épidémie. Près de 900 ont été infectés dans les trois pays « à transmission étendue intense » et environ les deux tiers sont décédés. La létalité a été la plus élevée en Sierra Leone (72 %) et comparable en Guinée (54,5 %) et au Libéria (51 %). Les professionnels de première ligne (médecins, infirmiers et agents techniques de santé) représentaient environ les deux tiers des infectés (60 à 70 % selon le pays) [17,23-25] [82],[85],[86],[87].
L'impact sanitaire indirect de l'épidémie a été très important dans les trois pays avec une baisse en moyenne de 50 % du recours aux structures de santé ; une diminution des activités des principaux programmes de prévention et de lutte contre les maladies infectieuses endémiques (paludisme, tuberculose, infection à VIH, maladie du sommeil et maladies à prévention vaccinale) et une augmentation de l'insécurité alimentaire grave estimée pour 2015 à plus d'un million de personnes touchées[88],[89],[90],[91]. Au total ces dysfonctionnements ont été à l'origine d'une augmentation de la mortalité maternelle (+74 %), infantile (+13 %) et des enfants de moins de 5 ans (+19 %), ainsi qu'un excès de décès pour quelques maladies infectieuses d'importance (paludisme, tuberculose, VIH, rougeole) supérieur de 40% au total des décès dus à Ebola[92],[93]. Cette crise sanitaire a eu un impact sur l'ensemble des secteurs socioéconomiques des trois pays à l'origine d'une baisse moyenne de 90 % de leur croissance et un coût global de 53 milliards de dollars dont 35 % liés aux décès non dus à Ebola[94],[80]. Outre la virulence du virus, le mal-développement et la pauvreté chronique des trois pays les plus atteints tous dotés de systèmes de santé précaires, le retard dans l'alerte initiale, la forte mobilité des populations, le défaut de coordination au début de la crise et le retard de la mobilisation internationale ; ce sont sans doute les insuffisances et les difficultés de la mobilisation communautaire et de la communication durant les premiers mois avec des populations méfiantes et très attachées à leurs coutumes ancestrales, qui ont contribué plus spécifiquement à l'ampleur géographique (90 % des préfectures-districts-comtés atteints dont les trois capitales) et à la gravité de cette épidémie, et qui expliquent en partie les limites de la riposte[82],[95].
Entérocoques résistants aux antibitiotiques
[modifier | modifier le code]
Les entérocoques sont des bactéries en forme de sphères (coques ou cocci) qui font partie de la flore commensale et se retrouvent notamment dans le tube digestif et les voies urinaires. Dans certaines circonstances ils deviennent des pathogènes opportunistes causant des septicémies, des infections urinaires, ou des infections intestinales[96]. En 2017, ils sont en France, la cause de 8 % des infections nosocomiales[97]. L'apparition assez récente d'épidémies nosocomiales dues à des entérocoques résistants aux glycopeptides (ERG) constitue une émergence liée à l'acquisition d'une résistance par des germes connus et ubiquitaires.
L'émergence de souches antibiorésistantes à la vancomycine et aux autres glycopeptides a probablement été favorisée par l'emploi mal maîtrisé des antibiotiques, chez l'humain, mais aussi en usage vétérinaire, agricole et dans l'industrie agroalimentaire[Note 8]. Une résistance aux antibiotiques peut résulter de l'utilisation abusive des antimicrobiens, d’un choix inapproprié pour traiter une infection précise, d’un manque d’observance au traitement de la part des patients ou même de l’utilisation abusive d’antibiotiques chez les animaux. Les bactéries multirésistantes, ainsi sélectionnées peuvent ensuite se transmettre et diffuser au sein des collectivités.
Bien qu'initialement apparues en Europe, c'est aux États-Unis que les souches d'ERG ont le plus rapidement diffusé dans les hôpitaux, représentant 28,5 % des souches d'entérocoques isolées en soins intensifs en 2003[HCSP 10]. En France, la proportion d'Enterococcus fæcalis isolés de patients souffrant d'infection nosocomiale est plus importante en 2017 qu’en 2012 avec une proportion égale à 6,50 % en 2017 contre 4,6 % en 2012. Ce microorganisme arrive au troisième rang des causes d’infection nosocomiale en 2017 alors qu’il n’arrivait qu’en cinquième rang en 2012. En 2016, il est isolé dans 4 % (stable depuis 2011) des bactériémies recensées par un des réseaux fédérés par l'Observatoire national de l'épidémiologie de la résistance bactérienne aux antibiotiques (ONERBA)[99]. Par ailleurs si Enterococcus fæcium est moins fréquent (1,51 % en 2017) il est plus souvent résistant à la vancomycine (5,07 % des souches en 2017)[97].
La lutte contre l'émergence des ERG, comme pour toute antibiorésistance, est justifiée par le besoin d'alléger la souffrance des patients, de raccourcir la durée des soins, d'éviter les complications de la maladie initiale, de diminuer la mortalité hospitalière, d'améliorer la qualité des soins, de limiter la contamination inter-établissements à l'occasion des transferts de malades, d'économiser le potentiel thérapeutique des antibiotiques disponibles, de baisser les coûts de prise en charge, etc.[100]
Facteurs d’émergence, de diffusion ou d’aggravation
[modifier | modifier le code]L’émergence correspond à une rupture d'équilibre d’un cycle infectieux d’origine animale (cycle enzootique ou parfois appelé cycle sylvatique lorsqu'il est d’origine forestière) voire du cycle d'un microorganisme commensal ou symbiotique de son hôte (passage d’état commensal ou symbiotique à un état infectieux chez son nouvel hôte)[101]. En effet le plus souvent l’hôte et le microorganisme se doivent de coexister pacifiquement, en équilibre, pour assurer leur propre survie. Ainsi les agents hautement pathogènes, susceptibles de détruire l’hôte sont éliminés, tout comme les hôtes sensibles dépourvus d’immunité acquise ou innée. L’émergence d’une maladie infectieuse dans une population humaine est alors un phénomène transitoire, erratique, conséquence d’une instabilité ou d’un changement brusque, rompant cet équilibre[HCSP 11].
De plus l'interaction entre un hôte et un agent pathogène est un équilibre complexe intégrant l’environnement dans lequel vivent ces deux acteurs. Ceci d’autant que la plupart des situations relèvent de maladies à transmission vectorielle ou animale (63 % des environ 2 000 maladies infectieuses humaines sont d’origine zoonotique), où de l’influence de conditions abiotiques (comme les conditions météorologiques) ou biotiques (comme la présence de prédateurs se nourrissant des espèces réservoirs) déterminantes. Si l’on parle beaucoup d’agents infectieux à transmission vectorielle, ils sont cependant très largement supplantées par les agents d’origine zoonotique ou animale[102]. La dynamique des infections et leur capacité à émerger sous forme nouvelle ou inhabituelle, nécessite une prise en compte globale, de l’agent infectieux, de l’environnement, de l’hôte (humain ou animal), ), de l’existence de vecteurs avérés ou possibles et de leurs interactions[HCSP 11].

Facteurs liés aux agents
[modifier | modifier le code]Les microbes ont la capacité d’évoluer et de s’adapter à leur environnement. Ils peuvent devenir plus virulents ou plus contagieux, produire de nouvelles toxines, devenir résistants aux médicaments, changer leur apparence pour tromper la mémoire immunitaire de leurs hôtes, devenir pathogènes alors qu’ils ne l’étaient pas auparavant[HCSP 12].
Facteurs liés aux vecteurs
[modifier | modifier le code]Un très grand nombre d’agents infectieux sont à transmission vectorielle obligatoire : l'agent parasitaire du paludisme par des insectes anophèles, l'agent bactérien de la maladie de Lyme par des tiques ixodes pour ne citer que deux exemples[Note 9]. Les espèces de vecteurs possèdent aussi la capacité de s’adapter. Ils peuvent devenir résistants aux pesticides. Cette résistance leur permet de se multiplier de façon incontrôlée et augmente les risques de transmission des agents microbiens dont ils sont porteurs[HCSP 12]. Les vecteurs peuvent aussi être introduits dans un nouvel environnement propice ou s’adapter à de nouvelles conditions environnementales ; il en va par exemple ainsi du commerce international de pneumatiques usagés qui a permis l’importation de plusieurs moustiques vecteurs en Europe[104], [105],[106].
Ils peuvent s'adapter au changement climatique et à l'augmentation de la température dans certaines régions du Monde, et ainsi propager des infections dans des zones qui en étaient indemnes[107]. Aujourd'hui, les recherches sur les vecteurs d'agents infectieux montrent non seulement leur rôle de transporteur et de disséminateur d'agents pathogènes pour l'humain, l'animal ou la plante, mais aussi celui, actif, de sélectionneur de formes pathogènes plus aptes à être transmises voire plus pathogènes.
Facteurs liés aux hôtes
[modifier | modifier le code]La susceptibilité de l’hôte à un agent pathogène peut augmenter du fait d'une immunodépression ou par la dégradation de ses barrières naturelles de protection (peau, muqueuse, etc.), ce qui diminue sa capacité à se défendre contre les agressions microbiennes. L’immunodépression peut être congénitale ou acquise. L'immunodépression acquise peut être le fait de maladies (dont une maladie émergente, le sida), de traitements médicaux, d'une grossesse, des maladies chroniques évolutives. Certains changements des comportements et d'habitudes de vie des populations humaines favorisent également l’émergence ou la réémergence des agents infectieux. Il en est ainsi de l’augmentation des voyages vers des destinations qui mettent l'humain en contact avec des agents contre lesquels il n’est pas immunisé, les phénomènes migratoires qui permettent l’introduction de populations non immunes dans de nouveaux environnements[108] , la persistance d’un habitat inadapté (c’est-à-dire dépourvu d’équipement de protection comme les moustiquaires aux portes et aux fenêtres), la libéralisation des comportements sexuels, l'usage de drogues injectables et le partage d'aiguilles. S’ajoutent également la globalisation du commerce international (lorsque l'humain ne voyage pas encore ce sont les denrées qui voyagent pour lui), ainsi que l’industrialisation du secteur agroalimentaire. Il en est de même pour les animaux qui hébergent des agents infectieux ; agents qui peuvent être circonscrits aux animaux uniquement (agents enzootiques) ou qui passent de l'animal à l'humain (agents zoonotiques). Les conditions environnementales, celles liées à la reproduction ou encore à la démographie peuvent prédisposer ou rendre sensibles des individus aux agents pathogènes. En condition d'élevage, les animaux de rente peuvent subir des infections à cause d'une densité élevée, de l'utilisation d'antibiotiques, ou, encore, des transports commerciaux d'animaux malades. Concernant la biodiversité et sa conservation, les interactions entre faune sauvage et faune domestique deviennent des sujets majeurs en matière de sécurité sanitaire et il en est de même concernant la flore. Concernant les MIE humaines, les représentations sociologiques de la maladie, les comportements culturels et les réactions individuelles relatifs à l'hygiène peuvent favoriser ou au contraire freiner l'émergence d'agents infectieux, mais aussi manipuler ou nier le discours scientifique[HCSP 13].
Facteurs liés à l’environnement
[modifier | modifier le code]
Les facteurs environnementaux favorisant l’émergence d’infections sont physiques, écologiques, socioéconomiques et organisationnels. Les changements physiques qui amènent un déséquilibre dans les écosystèmes peuvent être naturels (sècheresse ou inondation, etc.) ou anthropiques (déforestation, modifications de l'usage des sols, réchauffement climatique, pollution et effet de serre). Ces perturbations créent des conditions d’introduction et de propagation de nouveaux agents infectieux, de leurs vecteurs ou de leurs réservoirs hôtes.
Les bouleversements écologiques que connaît la planète (érosion de la biodiversité, modifications de l'usage des sols, pollutions, espèces invasives) ont des conséquences majeures en matière de santé et d’émergence infectieuse : de nombreuses régions où on assiste à l'apparition de MIE d’origine zoonotique ou sapronotique[Note 10] sont fortement associées à des perturbations environnementales, et en particulier à la perte de biodiversité et des habitats naturels qui l’héberge[110]. Les modifications de l’environnement socioéconomique, dont l’urbanisation, engendrent une forte augmentation de la densité de la population, l’accroissement de la pauvreté, les conflits armés et les déplacements massifs de populations, la globalisation des marchés ainsi que l'industrialisation agroalimentaire. Ces modifications s'accompagnent souvent d'une insuffisance de l'assainissement (accès à l'eau potable, réseau d'égout, collecte des déchets) et des structures de santé ou une détérioration de celles qui existent ce qui favorisent l'émergence des infections. Le nombre d'animaux de rente, mais aussi de nouveaux animaux de compagnie, à circuler dans le Monde ne cesse d'accroître et représente un risque important pour la transmission à large échelle de nouvelles infections mais aussi de plus anciennes pour l'animal et l'humain. L’organisation des systèmes de santé, particulièrement des structures de veille et de surveillance sanitaire peut aussi être défaillante (structures déficientes, sous-équipements, baisse de vigilance du personnel), voire inexistante, facilitant l'émergence ou la réémergence d'agents infectieux[HCSP 14]. Avec le développement de l'approche One Health, la nécessité de mieux combiner les structures de veille et de surveillance animale et humaine devient aujourd'hui une évidence, et milite en faveur d'une organisation évolutive et souple de ces institutions.
Classification des principaux déterminants d'émergences
[modifier | modifier le code]Parmi les déterminants d'émergence énumérés précédemment est-il possible d'établir un classement, un ordre d'importance qui ne sacrifie pas aux impressions, aux opinions, aux croyances, etc. ? Pour répondre scientifiquement à ce défi, des auteurs écossais ont recensé 177 agents infectieux (ou souches nouvellement pathogènes d'agents connus) ayant émergé au cours des quatre dernières décennies du XXe siècle. Au terme d'une revue de la littérature, pour chacune de ces maladies, les auteurs ont défini le déterminant majeur, principal responsable de leur émergence. Ils ont ensuite classé les déterminants selon le nombre total de pathologies différentes où chacun apparaît être le principal, en allant du plus grand nombre vers le plus petit[111]. Le Haut conseil de la santé publique, dans son rapport de 2011, a illustré ce classement en indiquant quelques émergences (mais survenues au cours des derniers siècles) principalement liées à chacun de ses déterminants[HCSP 15].
| Rang | Déterminant (par importance décroissante) |
Quelques exemples (d'après Haut conseil de la santé publique[HCSP 16]) |
|---|---|---|
| 1 | Changements d'usage des sols, des pratiques agricoles et procédés liés | Infection à virus Nipah en Asie du Sud-Est, encéphalopathie spongiforme bovine |
| 2 | Changements démographiques, sociétaux et comportementaux | Coqueluche, sida, syphilis |
| 3 | Précarité des conditions sanitaires | Choléra, tuberculose |
| 4 | Liés à l’hôpital (nosocomial) ou à des erreurs de soins et de pratiques | Staphylococcus aureus, Pseudomonas aeruginosa |
| 5 | Évolution des agents pathogènes (résistances, augmentation de virulence) | Chikungunya, entérocoques résistants aux glycopeptides, grippes A/H1N1 en 1918 et 2009 et grippe aviaire |
| 6 | Contamination par les aliments, ou l’eau | Escherichia coli, encéphalopathie spongiforme bovine, Salmonella |
| 7 | Voyages et échanges humains intercontinentaux | Dengue, grippe saisonnière, grippe aviaire |
| 8 | Défauts, désorganisation des systèmes de santé et de surveillance | Maladie du sommeil en Afrique centrale, maladies à tique et tuberculose en ex-URSS |
| 9 | Transports de biens commerciaux et d’animaux | Virus Monkeypox, grippe aviaire, Salmonella |
| 10 | Changement climatique | Paludisme en Afrique de l’Est, dengue en Asie du Sud-Est, leishmaniose viscérale en Europe du Sud |

Le résultat de cette tentative de hiérarchisation peut surprendre. Il met tout particulièrement l'accent sur les activités et comportements humains, bien avant l'évolution et l'adaptation, comme caractéristiques propres aux agents pathogènes, vecteurs et hôtes de toujours devoir s'adapter. De même il met en exergue l'impact des activités agropastorales ce qui est en accord avec la place majoritaire des zoonoses mais aussi des formes sapronotiques (l'origine des bordetelles responsables des coqueluches humaine et animale, ou encore des clostridies causant le tétanos, est tellurique, c’est-à-dire originaire du sol et des racines de certaines plantes) parmi les maladies infectieuses affectant l'humain. Ainsi l'humain serait le principal acteur des phénomènes d'émergences d'agents pathogènes[HCSP 15].
Le dernier rang du réchauffement climatique dans ce classement peut surprendre, mais il faut rappeler d'une part qu'il est lui aussi une résultante de l'activité humaine et d'autre part que ce travail, publié en 2005, compile et analyse des publications parues dans les dernières décennies du XXe siècle époque où cette préoccupation était peut-être moins connue, et donc prise en compte, dans les études de compréhension des émergences. De surcroît, les transmissions infectieuses ou les émergences d’agents pathogènes peuvent être reliées directement à un autre déterminant que le changement climatique, ce dernier venant dans la plupart des situations exacerber des conditions existantes[112],[113]. Une étude récente reprenant plusieurs centaines d’articles consacrés aux relations entre changement climatique et maladies infectieuses, publiée en 2009, montre qu’il est difficile de mettre en évidence un rôle statistiquement mesurable, du changement climatique sur l’émergence et la distribution géographique de maladies infectieuses[114].
La plupart des études de la décennie 2010 étudiant l'influence du changement climatique sur la transmission de nouvelles infections, comme la dengue en Europe, montre des modèles de cartes de distributions spatiales bien moins importantes que celles produites il y a encore dix ans. En 2015, Philosophical Transactions of the Royal Society. Biological Sciences consacre un numéro spécial à ce sujet[115]. Tout au long de 14 articles il y est fait le point sur ce thème, et plusieurs auteurs affirment que les distributions de maladies infectieuses, modélisées dans un cadre de changements climatiques, ne prennent pas en compte, pour la plupart, l'influence de déterminants sociaux économiques et comportementaux intervenant à des échelles spatiales fines. Si on s'accorde à dire que le climat et son changement, et en particulier la température et la pluviométrie, sont importants dans la transmission de très nombreuses infections humaines ou animales, et en particulier celles à transmission vectorielle[116],[117],[118] de nombreux auteurs démontrent dans le même temps qu'à l’intérieur, voire aux bordures, des enveloppes de distribution modélisées, de très fortes hétérogénéités nationales et régionales peuvent être observées et dépendent de facteurs intervenant à ces échelles (performance du système de santé publique, moindre compétence du vecteur à transmettre un virus comme on l'observe dans le sud de l'Europe, etc.). Que ce soit pour la transmission du virus Zika en Amérique centrale et du Sud[119] ou du virus de la dengue en Europe[120] la tendance de recherche actuelle est de mieux prendre en compte l'influence de facteurs intervenant à des niveaux d'échelles spatiales différents comme l'importance de facteurs locaux socioéconomiques, comportementaux, sanitaires et politiques qui peuvent intervenir favorablement pour diminuer la morbidité et la mortalité, ou au contraire, l'aggraver.
Un travail de 2019 sur les cas de leishmaniose cutanée en Amérique Centrale et du Sud montre ainsi qu'en étudiant la distribution actuelle des cas de leishmaniose à l'échelle continentale les facteurs bioclimatiques sont prépondérants pour expliquer la distribution de cette parasitose. En revanche, en recherchant les facteurs explicatifs de cas à des échelles spatiales plus fines, comme la Guyane, ce sont alors des facteurs socioéconomiques qui modulent la distribution des cas de leishmaniose dans le territoire[121]. Ainsi, plus on se rapproche de la réalité du cycle infectieux ou parasitaire, plus ce sont des explications sociologiques ou humaines qui sont trouvées, et plus on s'en éloigne plus des composantes environnementales apparaissent. Les unes et les autres sont importantes à prendre en considération, dans leurs effets complémentaires ou synergiques, sans se polariser uniquement sur des variables souvent aussi plus faciles à obtenir. L'écologue Charles Elton travaillant sur des invasions biologiques avait remarqué ce même phénomène, resté dans l'histoire des sciences écologiques comme la « Elton's sound hypothesis »[Note 11]. Ainsi au fur et à mesure que des incertitudes ou des biais de connaissance sont levées, les projections faites concernant la distribution des maladies infectieuses dans un cadre de dérèglement climatique apparaissent ainsi plus réalistes et souvent moins catastrophistes que précédemment modélisées (voir Paul E. Parham et al. pour un tour d'horizon[115]).
Niveaux de préparation et de réponse à une alerte dans le monde
[modifier | modifier le code]À la suite de l'adoption du nouveau Règlement sanitaire international (RSI) et après avoir tiré les leçons de la crise induite par l'épidémie de maladie à virus Ebola en Afrique de l'Ouest, l'OMS a créé un cadre et un processus permettant aux pays de mesurer leurs capacités à mettre en œuvre le RSI[122]. Afin de répondre à la nécessité de mieux comprendre et mesurer, sur une base transparente, mondiale et récurrente, l'état des capacités de chaque pays pour prévenir, détecter et répondre rapidement aux menaces d'épidémie et de pandémie[123], un index global de sécurité sanitaire a été construit, et diffusé pour la première fois en par la Johns Hopkins Bloomberg School of Public Health en partenariat avec Nuclear Threat Initiative et The Economist Intelligence Unit[124]. Cet index, estime le niveau de préparation de 195 pays du monde à faire face à une épidémie, quelle soit due à une maladie émergente ou à une diffusion intentionnelle ou accidentelle d'un agent. Cet index a été calculé à partir du recensement et de la compilation des sources ouvertes émises par les pays et les institutions internationales et librement disponibles[125]. Son calcul, compile 140 critères, regroupés en 6 catégories : prévention, détection et déclaration, rapidité de la réponse, robustesse du système de santé, respect des normes internationales, risque environnemental global et vulnérabilité du pays. Un index global et 6 index catégoriels, tous cotés de zéro à 100 (note maximale) sont proposés.
L'index global de sécurité sanitaire moyen pour les 195 pays s'établit en 2019 à 40,2 sur 100 et pour les 60 pays à hauts revenus il s'établit en moyenne à 51,9 sur 100[124]:15. Seulement 13 pays (dont le Canada, la France et la Suisse pour l'espace francophone) sont considérés comme les mieux préparés à faire face au risque épidémique. Concernant les 6 index catégoriels les résultats sont les suivants. Pour la capacité à prévenir une émergence seulement 7% des pays obtiennent un score supérieur à 66,6 sur 100. Pour la capacité de détection et de déclaration se sont 19 % des pays qui atteignent ou dépasse 66,6 sur 100. Pour la rapidité de la réponse moins de 5% des pays atteignent le seuil de 66,6. Pour l'aptitude des systèmes de santé à répondre et leur robustesse l'index moyen est de 26,4 sur 100 en faisant le pire index catégoriel. Pour le respect des normes internationales, moins de 50% des pays ont émis des mesures de confiance au titre de la Convention internationale sur les armes biologiques ce qui situe leur capacité à respecter les normes et engagements internationaux relatifs aux menaces biologiques. Enfin pour le risque environnemental global et la vulnérabilité du pays, seuls 23 % des pays ont un index supérieur à 66,6 sur 100[124]:15.
Selon cette étude aucun pays n'est parfaitement préparé (l'index global maximal étant celui des États-Unis établit à 83,5 sur 100)[126] pour affronter une menace biologique que ce soit par une maladie infectieuse émergente ou par la libération accidentelle ou intentionnelle d'un agent pathogène[124]:20-28,[Note 12].
| Pays | Index de sécurité sanitaire global, 2019 |
|---|---|
| États-Unis | 83,5 |
| Royaume-Uni | 77,9 |
| Pays-Bas | 75,6 |
| Australie | 75,5 |
| Canada | 75,3 |
| Thaïlande | 73,2 |
| Suède | 72,1 |
| Danemark | 70,4 |
| Corée du Sud | 70,2 |
| Finlande | 68,7 |
| France | 68,2 |
| Slovénie | 67,2 |
| Suisse | 67,0 |
Préparation et réponse à une alerte au niveau international
[modifier | modifier le code]Préparation et réponse à une alerte en France
[modifier | modifier le code]La prise en compte du concept de MIE a progressivement entraîné ; la mise en place de groupes de réflexions politiques[33],[127] et de préparation à la réponse[HCSP 1]; la création d'équipes de recherche spécialisées[128], et la mise en place de financements destinés à la recherche [129].
Pour répondre à une émergence il faut s'y être préparé par avance sans savoir où, quand, comment, elle surviendra ni quel agent pathogène sera en cause. La première réponse nécessite donc une prise de conscience collective du risque que représentent les MIE. De celle-ci découle la préparation de tous les aspects de la réponse et leur intrication dans le temps et l'espace d'une société, d'un pays.
Capacités nécessaires à la préparation
[modifier | modifier le code]Pour prévenir et répondre à l’apparition sur son territoire de maladies infectieuses émergentes, la France s'est dotée de trois capacités. D'abord, d’un système de veille sanitaire capable de détecter des évènements inhabituels, d’établir leur nature infectieuse, de caractériser ses conséquences et la nature de l’agent. Ensuite d’une stratégie de préparation[130], fondée sur une planification ainsi que sur des moyens disponibles en permanence d’intervention rapide permettant d’éviter qu’un foyer ne s’étende et de disposition de montée en puissance rapide en cas de débordements de cette première ligne de défense. Enfin d'une organisation de gestion de crise professionnalisée[130], capable de gérer non seulement les aspects relevant des autorités de santé mais également ceux nécessitant la contribution d’autres secteurs de la vie du pays (transports, ordre public, services de secours, agriculture…) est traitée séparément.
La mise sur pied de cette organisation et son maintien à un niveau opérationnel relèvent également de la stratégie de préparation (Cellule interministérielle de crise, Centre opérationnel de réception et de régulation des urgences sanitaires et sociales (CORRUSS)[131], moyens des centres opérationnels départementaux et des agences régionales de santé…). L’expérience a montré que cette organisation pouvait être adaptée en tenant compte des spécificités des MIE, notamment pour accélérer l’apport de la recherche scientifique[132].
Veille et surveillance
[modifier | modifier le code]Pour pouvoir répondre à une émergence il faut identifier au plus vite les deux caractéristiques qui vont orienter la réponse collective : la gravité de la maladie et sa contagiosité[HCSP 17]. Cette détermination devrait, dans l'idéal, survenir dès la première phase de l'émergence dans la population c'est-à-dire dès son introduction ce qui est d'autant plus difficile si l'agent est nouveau. La phase suivante est celle de la dissémination. Dès lors l'augmentation du nombre de patients ne doit pas être ignorée. Que ce soit dans la première ou la deuxième phase il faut pour cela disposer dès avant l'émergence de systèmes de surveillance épidémiologique et de veille sanitaire performants.
La surveillance épidémiologique est un système complet qui comprend la collecte systématique et continue, l'analyse et l'interprétation d’informations structurées avec productions d’indicateurs définis a priori[133]. Au premier temps, la collecte porte sur une information de base qui constitue un indicateur (symptôme, syndrome, diagnostic). Pour permettre le dépistage précoce d'une MIE il faut donc imaginer par avance les bons indicateurs à surveiller (ce qui est complexe pour une maladie qu'on ne connaît pas), mobiliser tous les acteurs susceptibles de reconnaître ces indicateurs, mettre en place le circuit de collecte, créer ou adapter l'organisme d'analyse et d'interprétation, définir la structure de décision[HCSP 18].
Le dispositif de veille sanitaire permet le recueil d'évènements inhabituels pouvant représenter une menace pour la santé publique et non pris en compte par les systèmes de surveillance qui reposent sur la collecte d’indicateurs. Il peut aussi s’agir d’évènements de toute nature ou origine, associés à une menace pour la santé publique : présentation clinique anormale d’un patient admis dans un hôpital, plainte de riverain d’un site pollué, excès de pathologies suspecté dans une collectivité ou entrefilet dans un journal local, par exemple[133]. D'autres informations, non-directement liées à la santé humaine, peuvent aussi être utiles à la compréhension d'un phénomène émergent (santé animale, météorologie, données de sécurité nationale, données de changement de comportement de la population, etc.) dont la collecte est plus difficile à organiser et généraliser ; leur place dans la réponse aux émergences est devenue prépondérante en France à la suite de la crise provoquée par la canicule européenne de 2003[133].
Par ailleurs, depuis 1994, la France dispose du Réseau national des laboratoires Piratox, renommé Biotox-Piratox à partir de 2001. Les laboratoires de ce réseau fournissent aux autorités les éléments d'évaluation du risque nécessaires à la prise de décision, en cas de survenue, suspecté ou avéré, d'un acte malveillant ou terroriste d'origine biologique ou chimique. Sa première mise en œuvre opérationnelle d’ampleur remonte à l'automne 2001, lors de la crise des enveloppes suspectées de contenir le bacille du charbon[134].
Planification et stocks d’intervention permanents
[modifier | modifier le code]Planification
[modifier | modifier le code]La planification implique non seulement les aspects relevant spécifiquement des autorités de santé mais également ceux nécessitant la contribution d'autres secteurs de la vie du pays (transports, défense, ordre public, services de secours, agriculture et alimentation…). Sous la responsabilité du Premier ministre, le Secrétariat général de la défense et de la sécurité nationale est chargé de coordonner l'élaboration des plans gouvernementaux, c'est-à-dire interministériels, destinés à répondre à l'apparition ou à la réapparition d'une MIE : plan « Pandémie grippale »[135], plan « Ebola » (fièvres hémorragiques)[136], plan « Variole »[137], plan « NRBC » pour tout acte conflictuel impliquant notamment des agents biologiques[138]. Cette planification précise la stratégie à appliquer, l'organisation de crise ainsi que les mesures pouvant être prises en fonction des situations et les moyens qui doivent être disponibles en tous temps (stocks de produits de santé et de dispositifs médicaux par exemple). Pour les situations sanitaires exceptionnelles (SSE), le ministère chargé de la santé a défini un cadre de planification[139] qui repose sur des plans zonaux et départementaux de mobilisation, préparés par les directeurs généraux d'agence régionale de santé (ARS) et arrêtés par les préfets, ainsi que sur le dispositif ORSAN (Organisation du système de santé) définissant une réponse stratégique globale[140]. Le ministère chargé de la santé tient également à jour des guides spécifiques de réponse du système de santé à des agents particuliers comme le guide « peste, charbon, tularémie ». Le dispositif ORSAN permet aux agences régionales de santé de mobiliser l'ensemble des secteurs de l'offre de soins face aux situations SSE, y compris celles dues aux MIE. Le dispositif ORSAN comprend un volet de prise en charge des patients dans le cadre du risque épidémique et biologique connu ou émergent (ORSAN-REB). De même, chaque établissement de santé doit décliner un plan de gestion des tensions hospitalières et des SSE, précisant un arsenal de mesures graduées activables en fonction de la nature, de l'ampleur et de la cinétique de l'évènement. Le guide d'aide à la préparation aux SSE[139] prévoit la prise en charge de patients atteints par un agent infectieux émergent (risque épidémique et biologique) de type Coronavirus ou fièvres hémorragiques virales. Si le ministère de la défense et notamment son Service de santé des armées dispose également de sa propre planification, son action est intimement coordonnée avec celle du ministère chargé de la santé. Le ministère chargé de l'agriculture dispose d'une planification en cas de maladies animales, couvrant des pathologies transmissibles à l'humain (zoonoses).
Stocks de produits de santé et de dispositifs médicaux
[modifier | modifier le code]Les stocks de produits et moyens de santé[141] sont dimensionnés et leur logistique est organisée en tenant compte de l'urgence des premières actions à réaliser et des difficultés possibles d'approvisionnement complémentaire en situation de crise. Ce volet de la préparation implique non seulement les moyens civils du ministère de la santé mais aussi la Pharmacie centrale des armées, seul organisme étatique disposant d'une capacité de production de produits de santé, tant pour les stocks permanents que pour réaliser une production complémentaire. Enfin, la préparation nécessite une information permanente des professionnels de santé, pour qu'ils connaissent le dispositif qui serait mis en œuvre, y compris pour la mise à leur disposition pendant la crise[141]. Les dispositifs médicaux ne concernent pas que le personnel de santé. Il faut aussi en prévoir pour les services de secours, certains opérateurs de transport, etc. Il s'agit du personnel le plus exposé lors de la prise en charge des malades (masques et tenues de protection, moyens de désinfection…).
Prise en compte du facteur humain
[modifier | modifier le code]Une difficulté majeure consiste à planifier un dispositif gradué dont le dimensionnement puisse être adapté en temps réel à l'ampleur de la crise rencontrée. À ce titre le comportement de la population reste l'un des paramètres les plus difficiles à anticiper et à intégrer, comme l'a montré la pandémie grippale de 2009[HCSP 19]. La planification doit également tenir compte du risque d'afflux de cas suspects ou de personnes inquiètes à l'entrée des établissements de soins ou des lieux de délivrance des produits de santé et des dispositifs de protection[139].
Gestion de crise
[modifier | modifier le code]Prise en charge des patients
[modifier | modifier le code]L'importance et les spécificités de la prise en charge des patients atteints de MIE ont fait irruption dans la médecine soignante sous l'impulsion de l'épidémie d'infection par le VIH dès le début des années 1980 [HCSP 20],[142]. Elle a fait depuis l'objet de multiples études, recherches cliniques, démarches de formalisation et de standardisation (mise en place de procédures opérationnelles) inhérentes à la dynamique de développement des connaissances en situation d'épidémie liée à un nouvel agent infectieux.
La prise en charge est au cœur de la réponse à une épidémie, les soignants qui en sont responsables étant en première ligne pour décrire le phénomène et contribuer à la construction de l'expertise[143]. La réponse nécessite en effet une adaptation permanente du système de santé, et plus largement de la société (pour protéger et limiter la contagion d'autres personnes) qui doivent s'appuyer sur la réalité d'une situation rapidement évolutive[144]. Il s'agit initialement d'une situation de grande incertitude, inhérente à la notion de MIE, qui concerne l'agent causal, parfois non identifié au début, les manifestations cliniques et paracliniques de la maladie qu'il provoque, les moyens de la reconnaître, d'en affirmer le diagnostic et de la différencier d'autres maladies infectieuses (MI) connues, et les moyens pour traiter les patients et prévenir l'infection chez des personnes exposées à cet agent infectieux. Dans ce contexte, la prise en charge des patients impose une coopération renforcée entre les professionnels de santé de diverses compétences, infectiologues, microbiologistes, hygiénistes, urgentistes etc., et les décideurs et gestionnaires de crise. Cette collaboration doit aussi s'étendre, au-delà du champ de la santé humaine, avec les autres secteurs de la société, vétérinaire, agricole, socio-politique pour une réponse globale et cohérente [145]. En effet, le développement d'une épidémie est comme celui d'un feu de forêt : pour en limiter les conséquences, tout doit être fait pour la maîtriser dès son démarrage. Dès lors, et de façon un peu caricaturale, on peut souligner que c'est de la prise en charge appropriée des premiers patients atteints de la MIE que dépend l'avenir de l’épidémie. La perte de chance des personnes malades du fait d'une prise en charge tardive et dégradée dans certains contextes défavorables, comme les épidémies récentes de fièvre hémorragique à virus Ebola en Afrique, l'illustre bien (cf. chapitre Ebola en Afrique de l'Ouest).
Le développement du sida a rappelé que la base de la prise en charge soignante est l'observation et la description du patient, réalisées par l'entretien (interrogatoire en langage médical) avec le patient (ou à défaut son entourage) et l'examen clinique. Il a promu la place du patient non seulement comme objet de soins, mais aussi comme acteur de sa propre santé. Il a remis en évidence (une épidémie étant constituée de personnes malades) que la prise en charge du patient est un déterminant majeur de la préparation et de la réponse à une alerte épidémique. Les alertes dues au charbon humain et au SRAS en 2001 et 2003, ont montré l'intérêt de regrouper les patients dans des établissements de santé spécialisés, dits en France établissements de santé référents (ESR) pour les MIE ou MI liées à un risque épidémique et biologique (REB). Dans cette perspective, la Coordination opérationnelle risque épidémique et biologique (COREB), mission nationale française, a été créée en 2014, pour animer le réseau de ces ESR[146],[147].
Elle a élaboré et publié une procédure générique pour la prise en charge des patients suspects d'infections REB par les premiers soignants[144]. Ses principaux éléments et illustrations sont rappelés ci-après.
Identification et classement des patients suspects de MIE
[modifier | modifier le code]Les éléments rapportés ci-dessus expliquent que l'identification des patients atteints de MIE peut être sujette à difficultés. Au début, tant que l'agent infectieux responsable n'est pas identifié ou que l'on ne dispose pas des outils de laboratoire aisément utilisables pour le reconnaître chez un patient donné, de nombreux patients présentant des manifestations compatibles avec une nouvelle maladie peuvent être soupçonnés d'être atteints d'une MIE. On parle ici de « patients suspects de MIE ».
Après quelque temps, le nombre de patients atteints réellement d'une MIE augmentant, il est possible de regrouper les données observées et de mieux caractériser et différencier les patients selon le niveau de probabilité diagnostique, on établit alors une définition du cas. On parle alors de "cas suspects", si les arguments sont modestes et la probabilité faible. On parle de patients ayant possiblement une MIE, appelés "cas possibles", si les arguments sont plus convaincants et la probabilité plus élevée. Et enfin de patients atteints de MIE confirmée, appelés "cas confirmés", si les tests de laboratoire ont identifié l'agent infectieux responsable chez le patient avec certitude[148]. Ces tests diagnostiques une fois établis permettent que chez bon nombre de patients suspects, le diagnostic de MIE soit exclu, on parle alors de « cas exclus » s'ils sont négatifs et si une autre MI connue est identifiée, ce qui n'est pas exceptionnel. À titre d'illustration, lors de l'épidémie de MVE en Afrique de l'Ouest en 2014, il y a eu en France plus de 1 000 patients suspects, 34 cas possibles et 2 cas confirmés chez 2 patients évacués[149].
Procédure générique de prise en charge des patients suspects
[modifier | modifier le code]La procédure générique est mise en route dès qu'une suspicion de MIE est évoquée par un soignant de première ligne[144]. Elle conjugue de façon ajustée à chaque situation, des mesures d'intérêts individuel et collectif, réalisées au cours de cinq étapes clés consistant à dépister, protéger, prendre en charge, alerter, orienter.
Accueil et dépistage, le rôle des premiers soignants
[modifier | modifier le code]Ces étapes clés de la démarche permettent de repérer les patients susceptibles d'être atteints de MIE. En première approche, il s'agit de personnes ayant des symptômes et manifestations compatibles avec cette nouvelle MI, et qui ont pu être exposés à l'agent de cette nouvelle MI. Il est donc essentiel, en cas d'alerte épidémique, que le patient fasse appel soit à son médecin traitant, soit au centre 15, chargé de coordonner les appels sur ce sujet. Bien souvent, le patient va s'adresser au service d'urgence de proximité, même si idéalement, en situation d'alerte de MIE, il faut éviter le recours à ces services hospitaliers afin de limiter le risque de contamination d'un grand nombre de personnes en salle d'attente[144].
Cette première rencontre et l'entretien avec le patient sont déterminants. Ils permettent de recueillir des informations clés, concernant la caractérisation de la maladie, de sa gravité et d'autres pathologies préexistantes pouvant interférer avec son évolution. Ces éléments sont indispensables pour orienter dès que possible la prise en charge dans la bonne voie. Leur qualité repose sur la confiance qui s'installe et se développe entre le médecin et la personne malade. Cette confiance « délicate » est à entretenir régulièrement au fil des rencontres. Elle est un enjeu majeur de l'adhésion de la personne au projet de soins et aux contraintes, au premier rang desquelles figure « l'isolement », des mesures de protection nécessaires. Les soignants de première ligne (qui sont les plus nombreux) doivent être formés au repérage d'un patient suspect, faire aussitôt appel à l'expertise de l'infectiologue référent REB correspondant, si besoin avec l'aide du centre 15, et mettre en place les premières mesures de protection, du personnel de santé et des personnes de l'environnement du patient. Le principe fondamental est ici « dépister = protéger jusqu'à preuve du contraire », les deux premières étapes de la procédure générique sont donc totalement interdépendantes[144]. De façon générique, les mesures de protection renforcées que doivent appliquer tous les soignants de première ligne devant tout patient suspect REB sont le port simultané d'un appareil de protection respiratoire (APR) de type FFP2, d'une sur-blouse et de gants et l'emploi systématisé de solution hydroalcoolique (SHA). Tandis que le patient REB fait l'objet d'une protection standardisée comportant le port d'un masque chirurgical et l'usage de SHA[144].
Après les premiers soins d'urgence requis, et l'information des experts concernés (infectiologue référent, Samu et agence régionale de santé - ARS), le patient est orienté dès que possible pour prise en charge dans une structure adaptée de consultation ou d'hospitalisation (généralement en ESR). Si la suspicion de MIE a été écartée dès cette première étape, le retour à domicile ou vers une structure de soins classique est envisagé[144].
Diagnostic, traitement, évolution
[modifier | modifier le code]Les premières mesures thérapeutiques interviennent dès que possible, les mesures de protection étant mises en place. Elles visent en priorité à corriger, si elles existent, les défaillances viscérales qui mettent enjeu le pronostic vital dans les premières heures. En cas de situation grave, il peut être nécessaire de réaliser des gestes de réanimation, massage cardiaque, assistance respiratoire, mise en place de perfusions[144].
Les traitements symptomatiques ont pour objectif de soulager et corriger les gênes, douleurs, toux, difficultés respiratoires, ressenties par la personne, désordres des fonctions rénale, circulatoire, etc. Essentiels, ils peuvent permettre d'améliorer considérablement l'état de santé du patient ; par exemple en Afrique de l'Ouest, en 2014, avant l'apparition de traitements spécifiques, ils ont permis de réduire la mortalité de la MVE de 70% à environ 25%[150],[151]. Ils doivent prendre en considération les attentes et les besoins des personnes malades, et les attentes de leurs familles afin d'être compris et acceptés.
Le diagnostic de l'agent infectieux responsable est déterminant, à partir de prélèvements réalisés chez le patient, dès les premières mesures thérapeutiques vitales appliquées. Il peut s'agir, selon la situation du patient de prélèvements de : sang, sécrétions respiratoires, selles, urines, peau, etc. Ils doivent être adressés dans des laboratoires spécialisés. Les prélèvements sont effectués et transportés dans des conditions de sécurité renforcées visant à éviter la contamination des professionnels manipulant ces prélèvements, au lit du patient et au laboratoire[144].
Les traitements spécifiques sont destinés à éradiquer l'agent infectieux. Il peut s'agir de médicaments anti-infectieux le détruisant ou l'empêchant de se développer : antibiotiques, antiviraux, anticorps spécifiques associés ou non aux précédents. Il peut aussi s'agir de produits visant à renforcer les moyens de défense de l'organisme humain contre l'agent infectieux, tels les vaccins. Ces produits sont utilisés pour essayer de guérir le patient, qu'il s'agisse de traitements curatifs ou traitements préventifs, et aussi pour éviter la transmission de la maladie chez des personnes à risque d'être infectées, car ayant été ou pouvant être en contact avec le patient. Ils doivent être administrés selon des modalités standardisées, par voie orale, en injection ou perfusion. Des recommandations, émanant d'instances nationales, tel le Haut conseil de la santé publique (HCSP), ou de sociétés savantes, et des procédures opérationnelles, guident leur utilisation, et doivent être régulièrement actualisées, au fil du progrès des connaissances.
L'évolution de la maladie peut être extrêmement variable, selon divers paramètres. La nature de l'agent infectieux, l'âge et l'état de santé préalable de la personne malade sont deux déterminants majeurs. Sont aussi importants l'accès au système de santé et aux soins, la disponibilité des outils diagnostiques et des moyens thérapeutiques, les conditions de prise en charge. Certaines MIE peuvent ainsi être bénignes et guérir rapidement et sans séquelles. D'autres peuvent être graves, avec survenue de complications au cours de la maladie, mettant en jeu le pronostic vital durant la phase aigüe, ou de séquelles d'apparition plus tardive, dont les conséquences peuvent se prolonger pendant des mois, après une amélioration initiale[56].
Interactions entre surveillance, recherche, information et soins
[modifier | modifier le code]
Des descriptions qui précédent, découle l'importance que la prise en charge de ces malades soit correctement coordonnée, et s'intègre dans une approche plus globale de réponse à une épidémie. Les interactions avec la surveillance épidémiologique sont essentielles pour la caractérisation des personnes atteintes et l'adaptation des soins à la probabilité diagnostique, l'évaluation de l'impact de l'épidémie en matière de morbidité et de mortalité et la contagiosité de la MIE avec les conséquences sociétales qui en découlent[HCSP 21]. La compréhension de la source de l'épidémie peut nécessiter des interactions avec des experts d'autres secteurs de la société, notamment vétérinaires et de l'environnement au sens large.
Les connaissances limitées invitent à mettre en œuvre au plus vite des travaux de recherche pour mieux définir la maladie, son risque et ses modalités de transmission, sa gravité, son évolution, ses conséquences et identifier des traitements curatifs et préventifs. Ces travaux doivent pouvoir être mis en route en urgence en vue de l'acquisition rapide de nouvelles connaissances visant à enrayer l'épidémie et en limiter les impacts sur les personnes et la société[HCSP 22]. Il faut souligner le nombre et la diversité des acteurs impliqués dans la prise en charge des personnes malades, soignants et autres professionnels des établissements (ESR) où sont pris en charge les patients et aussi de tous les autres établissements du territoire national où ils sont susceptibles de se présenter et d'être accueillis.
Le développement rapide des connaissances suppose l'information et la formation accélérées et soutenues, en temps réel, des acteurs impliqués, enjeu majeur afin de permettre leur adhésion aux contraintes fortes constituées par la prise en charge des personnes atteintes de MIE[152]. L'information sur les progrès de la prise en charge des patients doit aussi être largement partagée avec les citoyens afin de favoriser leur adhésion et leur confiance dans les décideurs et gestionnaires de la crise.
Protection de la collectivité
[modifier | modifier le code]Rôle des sciences humaines et sociales
[modifier | modifier le code]
Informer, éduquer les populations
[modifier | modifier le code]L'information et l’éducation sont une modalité de réponse aux émergences qui a souvent été privilégiée au cours des épidémies contemporaines. Ces actions peuvent revêtir de nombreuses formes, depuis l’information des populations par les leaders d’opinion (professionnels de la santé, éducateurs, journalistes, responsables politiques et religieux) jusqu’aux opérations de sensibilisation qui s’adaptent aux spécificités socioculturelles locales comme les concerts de rue, les récits oraux, ou les pièces de théâtre. Il s’agit à travers l’information et l’éducation de proposer aux individus et aux communautés des moyens d’agir efficaces pour préserver leur santé. Ainsi, pour l’OMS, ces modalités de réponse au risque sanitaire visent « à susciter l’intérêt du public pour la santé, renforcer les messages de santé, inciter les individus à obtenir plus d’informations et, dans certains cas, favoriser des modes de vie sains de façon durable[153] ».
Toutefois, il convient de noter que si l’information et l’éducation sont des conditions souvent nécessaires pour favoriser l’adoption de comportements protecteurs, les données de la littérature montrent que ces actions sont rarement suffisantes pour générer des changements de comportement[154]. Ainsi, dans le domaine de la vaccination, il est clairement apparu que la connaissance des maladies n’était pas corrélée au statut vaccinal des individus (ni même à l’intention de se faire vacciner[155]. Par ailleurs, il a été démontré dans plusieurs études expérimentales que les interventions visant à « rectifier » les idées fausses sur les maladies émergentes et leur prévention n’étaient pas dénués d’effets pervers, et pouvaient dans certains cas aboutir au renforcement de l'adhésion aux croyances erronées sur la nature et les causes de ces maladies dans les populations ciblées[156],[157].
Les apports des sciences humaines et sociales
[modifier | modifier le code]Après l’échec des recommandations en matière de prévention et de contrôle de la pandémie grippale A/H1N1, il a été reconnu par la direction de l’OMS que « convaincre les populations d’adopter des comportements protecteurs constituait l'un des plus grands défis pour la santé publique[158]. ». En santé publique, l’implantation de changements de comportements significatifs, rapides et massifs dans une population donnée est en effet une tâche particulièrement complexe et délicate, notamment en raison de phénomènes de dénégation et de minimisation du risque[159]. Dans le domaine des émergences, il semblerait toutefois que les changements de comportement soient favorisés par la dynamique épidémique[160]. Certains économistes ont ainsi défendu l’idée selon laquelle les comportements de prévention seraient sujets à des phénomènes d’élasticité-prévalence, c’est-à-dire que la fréquence des comportements de prévention tendrait à augmenter au fur et à mesure que la prévalence de la maladie augmente[161],[162]. Les enquêtes longitudinales montrent toutefois que la réponse des populations aux maladies émergentes n’est guère durable et que des effets d’épuisement ou d’accoutumance aux risques infectieux peuvent être observés dans les populations concernées au bout de quelques mois[163],[164]. Dans ce contexte l'intégration des sciences humaines et sociales dans la réflexion et l'élaboration à tous les étages de la réponse publique au risque de MIE semble indispensable [HCSP 23].
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Haut conseil de la santé publique, Les maladies infectieuses émergentes : état de la situation et perspectives, Paris, La documentation française, , 207 p. (ISBN 978-2-11-008586-3).

- Centre d’études et de prospective du ministère de l’Agriculture, de l’Agroalimentaire et de la Forêt, « Zoonoses émergentes et réémergentes : enjeux et perspectives », Analyse, no 66, (lire en ligne, consulté le ).
- Anne Debroise, Les maladies émergentes : Quand Les Virus Voyagent, Paris, Larousse, coll. « Petite encyclopédie Larousse », , 127 p. (ISBN 978-2-03-584813-0).
- Mirko D. Grmek, Histoire du sida : Début et origine d'une pandémie actuelle, Paris, Payot, , 392 p. (ISBN 978-2-228-88908-7).
- Mirko D. Grmek, « Le concept de maladie émergente », History and Philosophy of the Life Sciences, vol. 15, no 3, , p. 281-296 (lire en ligne).
- Serge Morand et Muriel Figuié, Émergence de maladies infectieuses : risques et enjeux de société, Versailles, QUAE GIE, , 136 p. (ISBN 978-2-7592-2490-6, lire en ligne).
- (en) Stephen S. Morse (dir.), Emerging Viruses, New York - Oxford, Oxford University Press, (ISBN 0-19-507444-0)
- Patrick Zylberman (gencode : 9782070140800 - code distributeur: A14080), Tempêtes microbiennes : Essai sur la politique de sécurité sanitaire dans le monde transatlantique, Paris, Gallimard, coll. « Collection NRF Essais », , 672 p. (ISBN 978-2-07-014080-0).

Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- Service Public Fédéral (SPF) Santé publique, Sécurité de la Chaîne alimentaire et Environnement - Belgique
- Centers for disease control and prevention - États-Unis
- Santé Publique France
- Institut national de santé publique du Québec - Canada
- Institut de médecine sociale et préventive de Genève - Suisse
- COREB mission nationale - Coordination Opérationnelle Risque Epidémique et Biologique
- Séminaire des maladies infectieuses émergentes
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- La notion d’émergence a néanmoins une préhistoire [5],[6],[7].
- Joshua Lederberg définira lui aussi les maladies émergentes comme des « maladies de civilisation »[11].
- Voir le chapitre 9 de l’Histoire du sida qui n’est autre que la reprise d’une communication faite par Mirko Grmek dans le cadre d’une conférence sur le sida organisée en juin 1987 par la Fondation Mérieux à Veyrier-du-Lac[12]. Cette même conférence accueillait également une communication d’Henri Mollaret, dont les formulations sont elles aussi extraordinairement proches des idées que Morse allait développer deux ans plus tard. Pour Mollaret, les infections sont le résultat de « deux mécanismes essentiels et distincts : le mode de circulation de l’agent infectieux et ses possibilités de pérennisation ». Tout dépend des rencontres entre le microbe et l’hôte humain, rencontres qui ne sont jamais fortuites car « elles dépendent directement des activités de l’homme ». « Inutile [donc] d’invoquer l’apparition de nouveaux agents pathogènes, il faut plutôt rechercher quels changements, même infimes, dans les relations de l’homme avec son environnement peuvent entraîner un contact jusqu’alors non établi. » Et l’auteur d’inviter les sciences humaines : éthologie, sociologie, histoire, à se joindre aux recherches en pathologie infectieuse[13]. Morse semble ignorer la communication de Mollaret. Hormis la circulation microbienne, qui n’est pas exactement thématisée ici, la doctrine de l’émergence était bien au départ une doctrine transatlantique.
- David Satcher est alors directeur des CDC d’Atlanta.
- Kilbourne fait ici allusion à W. H. McNeill[27].
- Au même moment, J.-C. Manuguerra reconnaissait pourtant l’importance des obstacles de nature politique qui s’opposent aux mesures nécessaires pour maîtriser l’épizootie aviaire (morcellement politique de l’Indonésie) comme ils favorisaient en 2001 le relâchement de la sécurité sanitaire à l’origine de la fièvre aphteuse en Grande-Bretagne (démantèlement des services vétérinaires)[30].
- Plus de 150 espèces hôtes ont été identifiées au Canada et aux États-Unis, certaines pouvant être infectées et en mourir comme les corneilles, corbeaux et geais bleus ; le ramassage et la manipulation des cadavres y étant formellement déconseillés[45].
- L'avoparcine (glycopeptide très utilisé en Europe) utilisée durant plus de 20 ans comme facteur de croissance dans la supplémentation alimentaire d'animaux d'élevage a pu sélectionner des entérocoques résistants à la fois à la vancomycine et à l'avoparcine. L'isolement de ces entérocoques résistants d'excréments de cochons et poulets d'élevages utilisant l'avoparcine, alors que les entérocoques isolés dans des fermes n'utilisant pas d'antibiotiques en supplémentation animale restaient sensibles aux glycopeptides, étaye cette hypothèse[98].
- Dans les cas des maladies infectieuses à transmission vectorielle, celle-ci se fait principalement par piqûres ou morsures d'arthropodes hématophages. Ceux-ci assurent la survie, la transformation, la multiplication et la transmission d’un agent infectieux. Ce sont essentiellement des acariens (surtout des Ixodida regroupant les tiques) et des insectes (essentiellement diptères, brachycères ou nématocères)[103].
- Le concept d’agents sapronotiques est récent, il réunit les organismes vivant librement dans le milieu extérieur et n’ayant pas besoin d’un contact avec un hôte pour se développer et persister, mais qui peuvent devenir infectieux lorsqu’ils se trouvent sur ou dans un hôte vivant[109].
- La traduction en français est plurielle, plusieurs possibilités pouvant traduire la pensée de Charles S. Elton : hypothèse du bruit de fond ou hypothèse vérifiable, correspondent bien à l’idée princeps.
- Il est à signaler que depuis sa publication en le rapport présentant l’index global de sécurité sanitaire n’a fait l’objet dans les médias que de présentations succinctes et d’aucune critique sur la méthodologie de recueil des données et de calcul des index.
Références
[modifier | modifier le code]- Rapport du Haut conseil de la santé publique (cf. Bibliographie)
- p. 1-207.
- p. 37-39.
- p. 36.
- p. 29.
- p. 38-39.
- p. 40-41.
- p. 39, 42-44.
- p. 39, 44-47.
- p. 50.
- p. 50-54.
- p. 59-60.
- p. 61.
- p. 61-62.
- p. 62.
- p. 62-65.
- p. 65.
- p. 86-87.
- p. 88.
- p. 121-124.
- p. 107-110.
- p. 85-103.
- p. 197-201.
- p. 139-140.
- Autres références
- Charles Nicolle, Destin des maladies infectieuses. Suivi du rôle international de la médecine et des médecins. Leçons du Collège de France, Paris, éditions France Lafayette, (1re éd. 1933), 216 p., p. 147-148.
- (en) Kate E. Jones et al., « Global Trends in Emerging Infectious Diseases », Nature, vol. 451, no 7181, , p. 990-994 (ISSN 0028-0836).
- Patrick Zylberman (gencode : 9782070140800 ; code distributeur: A14080), Tempêtes microbiennes : Essai sur la politique de sécurité sanitaire dans le monde transatlantique, Paris, Gallimard, coll. « Collection NRF Essais », , 672 p. (ISBN 978-2-07-014080-0), p. 51-58, 66-70.
- (en) Stephen S. Morse et A. Schluederberg, « Emerging viruses: The evolution of viruses and viral diseases », The Journal of Infectious Diseases, vol. 162, , p. 1-7 (ISSN 0022-1899).
- (en) Linda L. Klepinger, « The Evolution of Human Disease: New Findings and Problems », Journal of Biosocial Science, vol. 12, , p. 481-86 (ISSN 0021-9320).
- (en) Franck MacFarlane Burnet et D. O. White, Natural History of Infectious Disease, Cambridge, Cambridge University Press, , 4e éd., 288 p. (ISBN 978-0-521-08389-8), p. 1-21.
- (en) Franck Fenner, « The Effects of Changing Social Organisation on the Infectious Diseases of Man : Papers from a symposium held on », dans Stephen V. Boyden, The Impact of Civilisation on the Biology of Man, Toronto, University of Toronto Press, , 233 p. (ISBN 978-0802017284), p. 48-76 at Canberra.
- Stephen S. Morse 1993, p. 26.
- (en) Stephen S. Morse, « AIDS and Beyond: Defining the Rules for Viral Traffic », dans Elizabeth Fee and David M. Fox, AIDS, The Burdens of History, Berkeley, University of California Press, , 340 p. (ISBN 978-0520063969), p. 37, 41.
- Mirko Grmek, Histoire du sida : Début et origine d'une pandémie actuelle, Paris, Payot, , 392 p. (ISBN 978-2-228-88908-7), p. 169-173.
- (en) Joshua Lederberg, « Infection emergent », Journal of the American Medical Association, vol. 275, , p. 243-45 (ISSN 0098-7484).
- Sida : épidémies et sociétés, 20 et 21 juin 1987, Lyon, Fondation Marcel Mérieux, , 213 p. (ISBN 2-901773-50-8), p. 97-107.
- Henri H. Mollaret, « Interprétation socio-écologique de l’apparition des maladies réellement nouvelles », dans Sida : épidémies et sociétés, 20 et 21 juin 1987, Lyon, Fondation Marcel Mérieux, , 213 p. (ISBN 2-901-773-50-8), p. 108-112.
- Charles Anglada, Etude sur les maladies éteintes et les maladies nouvelles, pour servir à l’histoire des évolutions séculaires de la pathologie, Paris, JB Baillière et fils, , 648 p.
- Max Sorre, Les Fondements de la géographie humaine, t. 1 : les Fondements biologiques, Paris, Armand Colin, , 400 p.
- François Delaporte, « La nouveauté en pathologie », dans Rony Brauman, Forum Diderot, Vers de nouvelles maladies, Paris, éditeur=PUF, , 92 p. (ISBN 978-2130494119), p. 16, 22-23.
- Mirko Grmek, Histoire du sida : Début et origine d'une pandémie actuelle, Paris, Payot, , 3e éd. (1re éd. 1989), 492 p. (ISBN 978-2-228-88908-7), p. 354.
- Antoine Gessain et Jean-Claude Manuguerra, Les virus émergents, Paris, PUF, , 127 p. (ISBN 978-2-13-055543-8), p. 35.
- Jean-François Saluzzo, Pierre Vidal et Jean-Paul Gonzalez, Les virus émergents, Paris, IRD-Éditions, , 188 p. (ISBN 978-2-7099-1539-7, lire en ligne), p. 8-9.
- (en) Stephen S. Morse, « Examining the Origins of Emerging Viruses », dans Stephen S. Morse, Emerging Viruses, New York, Oxford University Press, , 317 p. (ISBN 978-0195104844), p. 10-27.
- (en) Robert Sallares, « Ecology, Evolution, and Epidemiology of Plague », dans Lester K. Little, Plague and the End of Antiquity. The Pandemic of 541-750, New York, Cambridge University Press, , 382 p. (ISBN 978-0521718974), p. 259.
- (en) Edwin D. Kilbourne, « Flu to the Starboard! Man the Harpoons! Fill’em With Vaccine! Get the Captain! Hurry! », The New York Times, , p. 32 (ISSN 0362-4331).
- Fernand Braudel, Civilisation matérielle, économie et capitalisme, XVe – XVIIIe siècle, t. 1. Les structures du quotidien, Paris, Armand Colin, coll. « Le Livre de Poche », , 542 p. (ISBN 2-200-25222-6), p. 89-92.
- (en) David Satcher, « Emerging Infections: Getting Ahead of the Curve », Emerging Infectious Diseases, vol. 1, , p. 1 (ISSN 1080-6040).
- (en) Walter R. Dowdle, « Influenza pandemic periodicity, virus recycling, and the art of risk assessment », Emerging Infectious Diseases, vol. 12, , p. 34-39 (ISSN 1080-6040).
- Edwin D. Kilbourne, « Afterword : A personnal summary presented as au guide for discussion », dans Stephen S. Morse, Emerging Viruses, New York, Oxford University Press, , 317 p. (ISBN 978-0195104844), p. 292.
- (en) William H. McNeill, « Control and Catastrophe in Human Affairs », Daedalus, vol. 118, no 1, , p. 11-12 (ISSN 0011-5266).
- (en) Stephen S. Morse, « Examining the Origins of Emerging Viruses », dans Stephen S. Morse, Emerging Viruses, New York, Oxford University Press, , 317 p. (ISBN 978-0195104844), p. 24.
- Antoine Gessain et Jean-Claude Manuguerra, Les virus émergents, Paris, PUF, , 127 p. (ISBN 978-2-13-055543-8), p. 31-32.
- Jean-Yves Nau, « Il faudra vivre avec le H5N1 chez les oiseaux sauvages : Le responsable de la cellule française d'intervention biologique d'urgence fait le point sur la grippe aviaire. », Le Monde, .
- (en) Joshua Lederberg, « Viruses and Humankind: intracellular symbiosis and evolutionary competition », dans Stephen S. Morse, Emerging Viruses, New York, Oxford University Press, , 317 p. (ISBN 978-0195104844), p. 3-4.
- Hélène Fagherazzi-Pagel, Maladies émergentes et réémergentes chez l’homme : concepts, facteurs d’émergence, alertes, riposte mondiale : Rapport de recherche, Institut de l’Information Scientifique et Technique (INIST-CNRS), , 89 p. (lire en ligne), p. 40-41.
- Fabienne Keller, Rapport d'information fait au nom de la délégation sénatoriale à la prospective sur les nouvelles menaces des maladies infectieuses émergentes, , 233 p. (lire en ligne), chap. 638.
- « Le trésor de la langue française informatisé », sur Analyse et traitement informatique de la langue française (consulté le ).
- « émergence », sur Larousse (consulté le ).
- « Réémergence », sur Encyclopædia Universalis (consulté le ).
- Michel Pépin et al., « Émergence des maladies infectieuses animales et humaines », Productions Animales, INRA, vol. 20, no 3, , p. 199-206 (ISSN 2273-7766).
- (en) Patrice Binder et al., « Medical management of biological warfare and bioterrorism; lesson from the recent past to the future », Comparative Immunology Microbiology and Infectious Diseases, vol. 26, , p. 401-421 (ISSN 0147-9571).
- (en) P.M. Sherman et al., « Bacterial infections: new and emerging enteric pathogens », Currents opinion in Gastroenterology, vol. 26, , p. 1-4 (ISSN 1531-7056).
- (en) « NIAID Emerging Infectious Diseases/ Pathogens », sur NIAID, (consulté le ).
- « Déclaration sur la deuxième réunion du Comité d’urgence du Règlement sanitaire international (2005) concernant la flambée de nouveau coronavirus 2019 (2019-nCoV) tenue le 30 janvier 2020 », sur who.int (consulté le ).
- (en) « Novel Coronavirus (2019-nCoV) », sur who.int, OMS (consulté le ).
- (en) Alexander E. Gorbalenya et al., « Severe acute respiratory syndrome-related coronavirus – The species and its viruses, a statement of the Coronavirus Study Group », bioRxiv, (DOI 10.1101/2020.02.07.937862, lire en ligne, consulté le ).
- (en) Jamie Gumbrecht et Jacqueline Howard, « WHO declares novel coronavirus outbreak a pandemic », sur CNN (consulté le ).
- « Virus du Nil occidental », sur Centre canadien d’hygiène et de sécurité du travail (consulté le ).
- (en) A.A. Marfin et D.J. Gubler, « West Nile encephalitis: an emerging disease in the United States », Clinical Infectious Diseases, vol. 33, , p. 1713-1719 (ISSN 1537-6591).
- (en) « West Nile virus », sur Centers for disease control and prevention (consulté le ).
- (en) L.R. Petersen, P.J. Carson et al., « Estimated cumulative incidence of West Nile Virus infection in US adults, 1999–2010 », Epidemiology and Infection, no 141, , p. 591–595 (ISSN 0950-2688, DOI 10.1017/S0950268812001070, lire en ligne [PDF]).
- Marc Gozlan, « Zika : Histoire d’un virus émergent », sur Le Monde.fr (consulté le ).
- Antonio Victor Campos Coelho et Sergio Crovella, « Microcephaly Prevalence in Infants Born to Zika Virus-Infected Women: A Systematic Review and Meta-Analysis », International Journal of Molecular Sciences, vol. 18, no 8, (ISSN 1422-0067, DOI 10.3390/ijms18081714).
- (en) Bruno Hoen et al., « Pregnancy Outcomes after ZIKV Infection in French Territories in the Americas », The New England Journal of Medicine, vol. 378, no 15 mars 2018, , p. 985-994 (ISSN 0028-4793, lire en ligne).
- Bertho Audifax, L’épidémie à virus Chikungunya à La Réunion et à Mayotte. Rapport d’information n°3242, Paris, Assemblée Nationale, , 328 p..
- (en) M. Vazeille et al., « Two Chikungunya isolates from the outbreak of La Reunion (Indian Ocean) exhibit different patterns of infection in the mosquito, Aedes albopictus », PLoS One Medicine, no 2(11): e1168, (e-ISSN 1549-1676, lire en ligne).
- (en) Fabrice Simon et al., « Chikungunya infection, an emerging rheumatism among travellers returned frome Southwestern Indian Ocean: report of 47 cases », Medicine, vol. 86, , p. 123-137 (ISSN 1536-5964).
- (en) Benjamin Queyriaux et al., « Clinical burden of chikungunya virus infection », The Lancet Infectious Diseases, vol. 8, , p. 2-3 (ISSN 1473-3099).
- (en) Catherine Marimoutou et al., « Chikungunya infection: self-reported rheumatic morbidity and impaired quality of life persist 6 years later », Clinical Microbiology and Infection, vol. 21, , p. 688-693 (ISSN 1198-743X, DOI https://doi.org/10.1016/j.cmi.2015.02.024).
- « La fièvre catarrhale ovine (FCO), ou Bluetongue. Présentation et situation en France », sur Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, (consulté le ).
- « Thématique fièvre catarrhale ovine », sur Plateforme ESA - Épidémiosurveillance santé animale, (consulté le ).
- « Institut de veille sanitaire. Rapport annuel 2009 », sur InVS, (consulté le ), p. 10-21.
- « Le point sur les paramètres épidémiologiques dans l’épidémie due au nouveau virus de la grippe A(H1N1)v », Bulletin épidémiologique hebdomadaire- web, (lire en ligne, consulté le ).
- Maria D. Van Kerkhove et al., « Estimating age-specific cumulative incidence for the 2009 influenza pandemic: a meta-analysis of A(H1N1)pdm09 serological studies from 19 countries », Influenza and Other Respiratory Viruses, vol. 7, , p. 872-886 (ISSN 1750-2659, lire en ligne).
- « Les décès causés par la grippe A revus à la hausse », sur figaro.fr, (consulté le ).
- Jean-Christophe Lagarde et Jean-Pierre Door, Rapport sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A (H1N1)éditeur=Assemblée nationale, , 742 p. (lire en ligne).
- Paul Benkimoun, « Stocks de vaccins antigrippe A : le gouvernement sur la sellette. Les revirements gouvernementaux ont suscité questions et critiques dans l'opposition et la majorité. », sur Le Monde, .
- Catherine Vincent, « L'OMS sommée de s'expliquer sur la grippe A. Le Conseil de l'Europe s'interroge sur l'influence de l'industrie pharmaceutique dans la gestion de la pandémie. », sur Le Monde, .
- (en) World Health Organization, « Ebola haemorrhagic fever in Zaïre », Bulletin World Health Organization, vol. 56, no 2, , p. 271-93 (lire en ligne, consulté le ).
- (en) Peter D. Walsh et al., « Catastrophic ape decline in western equatorial Africa », Nature, vol. 422(6932), no Apr 10, , p. 611-14 (lire en ligne, consulté le ).
- (en) Sylvain Blaize et al., « Emergence of Zaire Ebola Virus Disease in Guinea — Preliminary Report », The New England Journal of Medicine, (DOI 10.1056/NEJMoa1404505).
- Organisation mondiale de la santé, « Une année d’épidémie d'Ebola : un virus mortel, tenace et impitoyable »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), (consulté le ).
- René Migliani, « Épidémie d'Ebola, 2013-2016 », Notes techniques de l'Agence Française de Développement, vol. 30, , p. 64-8 (lire en ligne, consulté le ).
- (en) Almudena M. Saéz et al., « Investigating the zoonotic origin of the West African Ebola epidemic », EMBO Mol Med, vol. 7, , p. 17–23 (lire en ligne, consulté le ).
- (en) Stephen K. Gire et al., « Genomic surveillance elucidates Ebolavirus origin and transmission during the 2014 outbreak », Science, vol. 345, , p. 1369-72 (lire en ligne, consulté le ).
- (en) Nadia Wauquier et al., « Understanding the emergence of Ebola Virus Disease in Sierra Leone: stalking the virus in the threatening wake of emergence », PLOS Currents Outbreaks, no Apr 20, (DOI 10.1371/currents.outbreaks.9a6530ab7bb9096b34143230ab01cdef, lire en ligne, consulté le ).
- (en) James Fairhead, « Understanding social resistance to Ebola response in Guinea », African Studies Review, vol. 59, , p. 7-31 (lire en ligne, consulté le ).
- « Ebola au Liberia : des corps abandonnés dans les rues », La Presse, (lire en ligne, consulté le ).
- Arnaud Bizot, « Le massacre de Womey », Paris Match, (lire en ligne, consulté le ).
- Michèle Cros, « Du sida à Ebola : rites de mort à fonction apotropaïque », L'autre, cliniques, cultures et sociétés, vol. 16, , p. 263-74 (lire en ligne, consulté le ).
- (en) United Nations Secretary-General, « Statement by the Secretary-General on the establishment of the United Nations Mission for Ebola Emergency Response (UNMEER) », (consulté le ).
- Nations Unies, « Incidences socio-économiques d'Ebola sur l'Afrique »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), (consulté le ).
- (en) Caroline Huber et al., « The Economic and Social Burden of the 2014 Ebola Outbreak in West Africa », The Journal of Infectious Diseases, vol. 218, no S5, , S698-704 (ISSN 0022-1899, lire en ligne, consulté le ).
- (en) « Ebola Ça Suffit ! Ring Vaccination Trial Consortium. The ring vaccination trial: a novel cluster randomised controlled trial design to evaluate vaccine efficacy and effectiveness during outbreaks, with special reference to Ebola », British Medical Journal, vol. 351 passage=h3740, (lire en ligne, consulté le ).
- (en) Ana Maria Henao-Restrepo et al., « Efficacy and effectiveness of an rVSV-vectored vaccine expressing Ebola surface glycoprotein: interim results from the Guinea ring vaccination cluster-randomised trial », Lancet, vol. 386, , p. 857-66 (lire en ligne, consulté le ).
- (en) Ana Maria Henao-Restrepo et al., « Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!) », Lancet, vol. 389, (DOI https://doi.org/10.1016/S0140-6736(16)32621-6, lire en ligne, consulté le ).
- René Migliani, « Ebola 3 ans après : le point sur la dynamique de l’épidémie », Colloque « Ebola, 3 ans après : Les grandes questions ». Institut Pasteur à Paris, (consulté le ).
- (en) World Health Organization, « Health workers Ebola infections in Guinea, Liberia and Sierra Leone. A preliminary report », (consulté le ).
- Organisation mondiale de la santé, « Rapport de situation sur la flambée de maladie à virus Ebola », sur OMS, (consulté le ).
- René Migliani et al., « Maladie à virus Ebola en Guinée : évolution de l’épidémie de son émergence en décembre 2013 à novembre 2015 », Médecine et armées, vol. 44, , p. 149-60 (lire en ligne, consulté le ).
- (en) Kim J. Brolin Ribacke et al., « Effects of the West Africa Ebola virus disease on health-care utilization - A systematic review », Frontiers in Public Health, vol. 4, , article no 222. eCollection 2016 (e-ISSN 2296-2565, lire en ligne, consulté le ).
- (en) Mariame Camara et al., « Impact of the Ebola outbreak on Trypanosoma brucei gambiense infection medical activities in coastal Guinea, 2014-2015: a retrospective analysis from the Guinean national Human African Trypanosomiasis control program », PLoS Neglected Tropical Diseases, vol. 11, , article no e0006060 (e-ISSN 1935-2735, lire en ligne, consulté le ).
- (en) Alyssa S. Parpia et al., « Effects of Response to 2014-2015 Ebola Outbreak on Deaths from Malaria, HIV/AIDS, and Tuberculosis, West Africa », Emerging Infectious Diseases, vol. 22, , p. 433-41 (ISSN 1080-6040, lire en ligne, consulté le ).
- Organisation des Nations Unies pour l'alimentation et l'agriculture, « Ebola laisse des centaines de milliers de personnes confrontées à la faim », sur FAO.org, .
- (en) David K. Evans et al., « Health-care worker mortality and the legacy of the Ebola epidemic », Lancet, , e439-40 (ISSN 0140-6736, lire en ligne, consulté le ).
- (en) World Health Organization, « WHO methods and data sources for country-level causes of death 2000-2016 », sur OMS, (consulté le ).
- (en) World Bank, « 2014-2015 West Africa Ebola crisis: Impact update », (consulté le ).
- Bernard Seytre, « Les errances de la communication sur la maladie à virus Ebola », Bulletin de la Société de pathologie exotique, vol. 109, , p. 314-23 (ISSN 0037-9085, lire en ligne, consulté le ).
- Katia Stucki et al., « Infections à entérocoques : du plus simple au plus complexe… », Revue médicale suisse, vol. 10, , p. 1918-1923 (lire en ligne).
- C. Daniau et al., « Enquête nationale de prévalence des infections nosocomiales et des traitements anti-infectieux en établissements de santé, France, mai-juin 2017. », Rapports et synthèses, Santé Publique France, (ISBN 979-10-289-0448-7, lire en ligne).
- (en) R. Leclercq et al., « Transferable vancomycin and teicoplanin resistance in Enterococcus fæcium », Antimicrobial Agents Chemotherapy, vol. 33, no 1, , p. 10-15 (lire en ligne).
- Conseil scientifique de l'Onerba, « Rapport annuel 2017 », sur Onerba (consulté le ), p. 48.
- « L’antibiorésistance : pourquoi est-ce si grave ? », sur Ministère des Solidarités et de la Santé, (consulté le ).
- Jean-François Guégan et al., « Forêts tropicales, changements d’usage des sols et risques infectieux émergents », Santé Publique, vol. 31, no hors série, , p. 91-1060 (ISSN 0995-3914).
- (en) Kris A. Murray et al., « Pathogeography: leveraging the biogeography of human infectious diseases for global health management », Ecography, vol. 41, , p. 1–17 (DOI 10.1111/ecog.03625).
- Vincent Robert, « Introduction aux arthropodes nuisants, aux vecteurs et aux maladies à transmission vectorielle », dans Gérard Duvallet, Ludovic de Gentile, Protection personnelle antivectorielle, Marseille, IRD éditions, coll. « Didactiques », , 352 p. (ISBN 978-2-7099-1718-6), p. 25-49.
- Jean Dorst et al., « Première observation d’Aedes albopictus (Skuse, 1894) en France métropolitaine », Comptes Rendus de l'Académie des Sciences - Series III - Sciences de la Vie, vol. 323, no 4, , p. 373-375 (ISSN 0764-4469, lire en ligne).
- R. Romi et al., « Aedes atropalpus, un nouveau moustique importé en Italie lors de transports de pneus usagés », Parasite, vol. 4, no 4, , p. 343-349 (ISSN 1252-607X, lire en ligne).
- Slimane Boukraa et al., « Réintroduction du moustique invasif Aedes albopictus en Belgique en juillet 2013 », Parasite, vol. 20, no 54, (ISSN 1252-607X, 10.1051/parasite/2013054).
- Jean-François Guégan et Frédéric Simard, « Changements environnementaux et maladies infectieuses : mieux coordonner la surveillance », Actualité et dossier en santé publique, no 93, , p. 22-28 (ISSN 1243-275X).
- L.H Chen et al., « The role of the traveler in emerging infections and magnitude of traval », The medical clinics of North America, vol. 92, , p. 1409-1432 (ISSN 0025-7125).
- Armand M. Kuris et al., « Sapronosis : a distinctive type of infectious agent », Trends in Parasitology, vol. 30, , p. 386-393 (ISSN 1471-4922).
- Jean-François Guégan, « Une grande partie des maladies émergentes résultent des pressions humaines sur les écosystèmes », Pour La Science, no 469, , p. 86-88.
- (en) Mark EJ Woolhouse et Sonya Gowtage-Sequeria, « Host range and emerging and reemerging pathogens », Emerging Infectious Diseases, vol. 11, no 12, , p. 1842-1847 (ISSN 1080-6059, lire en ligne).
- Olivier Plantard et al., « Vers une écologie de la santé », Pour la Science, no 438, , p. 70-755 (ISSN 0153-4092).
- Jean-François Guégan, « Changement climatique et santé : des liens complexes », Pour la Science. Dossier, no 89, , p. 30-32 (ISSN 1246-7685).
- (en) Kevin D. Lafferty, « The ecology of climate change and infectious diseases », Ecology, vol. 90, , p. 888-900 (ISSN 1939-9170, lire en ligne).
- (en) Paul E. Parham et al., « Climate change and vector-borne diseases of humans », Philosophical Transactions of the Royal Society. Biological Sciences, , article no 370 (lire en ligne).
- (en) Jane P Messina et al., « Mapping global environmental suitability for Zika virus », eLife, , article no 5:e15272 (DOI 10.7554/eLife.15272).
- (en) Blanka Tesla et al., « Temperature drives Zika virus transmission: evidence from empirical and mathematical models », Philosophical Transactions of the Royal Society. Biological Sciences, , article no 285: 20180795 (lire en ligne).
- (en) Mallory Harris et al., « Climate drives spatial variation in Zika epidemics in Latin America », Philosophical Transactions of the Royal Society. Biological Sciences, , article no 286: 20191578 (lire en ligne).
- (en) F.J. Colón-González et al., « After the epidemic: Zika virus projections for Latin America and the Caribbean », PLoS Negl Trop Dis, vol. 11, , article no (11): e0006007 (lire en ligne).
- (en) Eduardo Massad et al., « Estimating the probability of dengue virus introduction and secondary autochthonous cases in Europe », Scientific Reports, vol. 8, , article no 4629 (DOI 10.1038/s41598-018-22590-5).
- (en) Agathe Chavy et al., « Ecological niche modelling for predicting the risk of cutaneous leishmaniasis in the Neotropical moist forest biome », PLoS Negl Trop Dis, vol. 13, , article no e0007629 (lire en ligne).
- Jennifer Nuzzo, « Johns Hopkins Center for Health Security Teams with NTI and the Economist Intelligence Unit to Develop a Global Health Security Index », sur The bifurcated needle, (consulté le ).
- United Nations General Assembly, « Protecting humanity from future health crises: Report of the High-level Panel on the Global Response to Health Crises ».
- « GHS Index : Global Health security index. Building Collective Action and Accountability » [PDF], sur ghsindex.org/ (consulté le ).
- Carrie Creasey, « Assessing Global Health Security: Are We Ready for the Next Pandemic? », sur Homeland Security Digital Library, (consulté le ).
- « Global Health Security Index finds gaps in preparedness for epidemics and pandemics : Even high-income countries are found lacking and score only in the average range of preparedness », sur ScienceDaily, (consulté le ).
- Roger Karoutchi et Fabienne Keller, Rapport d'information fait au nom de la délégation sénatoriale à la prospective sur la prévention et la gestion des crises liées aux maladies infectieuses émergentes, , 89 p. (lire en ligne), chap. 472.
- « Maladies virales émergentes : un défi pour la science. Les dossiers thématiques de l'IRD », sur Institut de recherche pour le développement (consulté le ).
- « Annexe au Plan d’action 2018 (B.11 Axe 7 : Santé – environnement comprenant le concept « One Health », pathogènes et maladies infectieuses émergentes ou ré-émergentes, résistance aux antimicrobiens », sur Agence nationale de la recherche, (consulté le ), p. 90.
- Secrétariat général à la défense et la sécurité nationale, « Directive générale interministérielle n° 320/SGDSN/PSE/PSN du 11 juin 2015 relative à la planification de défense et de sécurité nationale » (consulté le ).
- Ministère des solidarités et de la santé, « La gestion des alertes et des crises sanitaires » (consulté le ).
- Ministère des solidarités et de la santé, « Réponse de la France à la crise Ebola », 4e trimestre 2014 (consulté le ).
- Institut de veille sanitaire, La veille et l’alerte sanitaires en France, Saint-Maurice (France), Institut de veille sanitaire, , 60 p. (ISBN 978-2-11-099483-7, lire en ligne).
- Secrétariat général à la défense et à la sécurité nationale, « Instruction interministérielle relative à la structure et au fonctionnement du réseau national des laboratoires « BIOTOX- PIRATOX » », (consulté le ).
- Ministère des solidarités et de la santé, « Plan national de prévention et de lutte « Pandémie grippale » », (consulté le ).
- Secrétariat général à la défense et à la sécurité nationale, « Plan national de prévention et de lutte « Maladie à virus Ebola » »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), (consulté le ).
- Agence nationale de sécurité du médicament et des produits de santé, Rapport d'activité 2017, 196 p. (lire en ligne), p. 146.
- Secrétariat général à la défense et à la sécurité nationale, « Améliorer les dispositifs de prévention et de protection » (consulté le ).
- Ministère des solidarités et de la santé, Guide d'aide à la préparation et à la gestion des tensions hospitalières et des situations sanitaires exceptionnelles au sein des établissements de santé, , 222 p. (lire en ligne).
- « Décret n°2016-1327 du 6 octobre 2016 relatif à l'organisation de la réponse du système de santé (dispositif « ORSAN ») et au réseau national des cellules d'urgence médico-psychologique pour la gestion des situations sanitaires exceptionnelles », JORF, (lire en ligne, consulté le ).
- « Circulaire interministérielle n°327/DGS/DUS/DGSCGC/2013/ du 21 août 2013 relative au dispositif de stockage et de distribution des produits de santé des stocks stratégiques de l'Etat pour répondre à une situation sanitaire exceptionnelle » (consulté le ).
- « 15 ans d’activisme thérapeutique : petite anthologie »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur trt5.org groupe interassociatif Traitements et Recherche Thérapeutique, (consulté le ).
- Marc Souville, « Le savoir et le risque : appropriation et adaptation des connaissances en médecine générale », Sociétés, vol. 77, no 3, , p. 21-36 (DOI 10.3917/soc.077.0021., lire en ligne, consulté le ).
- « Procédure générique standardisée de prise en charge par les médecins de première ligne des patients suspects d’infections à risque épidémique et biologique (REB) - les 10 points-clés » [PDF], sur coreb.infectiologie, (consulté le ).
- « Séminaire des Maladies infectieuses émergentes », sur Malinfemerg.org, (consulté le ).
- « Coordination opérationnelle du risque épidémique et biologique », sur coreb.infectiologie, (consulté le ).
- « Référentiel Technique REB. Cahier des charges des Etablissements de Santé de Référence (ESR) pour la prise en charge des patients atteints d’infection REB » [PDF], sur coreb.infectiologie, (consulté le ).
- Pascal Astagneau, Thierry Ancelle et al., Surveillance épidémiologique : principes, méthodes et applications en santé publique, Paris, Lavoisier S.A.S., , 360 p. (ISBN 978-2-257-20426-4, lire en ligne), p. 328.
- « Renforcement de la surveillance Ebola en France au cours de l'épidémie de grande ampleur en Afrique de l'Ouest, mars 2014 - janvier 2016 », sur Santé Publique France, (consulté le ).
- (en) François Lamontagne, « Evidence-based guidelines for supportive care of patients with Ebola virus disease », The Lancet, vol. 391, , p. 700–708 (DOI 10.1016/S0140-6736(17)31795-6).
- Mission COREB nationale, « Prise en charge thérapeutique d’un patient atteint demaladie avérée à virus Ebola (MVE) en France » [PDF], (consulté le ).
- « Référentiel national de formation à la prise en charge des patients atteints d’infection liée à un Risque Epidémique et Biologique (REB)1 en Etablissement de Santé de Référence (ESR) » [PDF], sur coreb.infectiologie, (consulté le ).
- Glossaire de la promotion de la santé, Genève, OMS, , 25 p. (lire en ligne).
- Gaston Godin, Les comportements dans le domaine de la santé, Montréal, Presses de l'Université de Montréal, , 328 p. (ISBN 978-2-7606-3154-0).
- (en) « Systematic literature review of the evidence for effective national immunisation schedule promotional communications », sur European Centre for Disease Prevention and Control, (consulté le ).
- (en) Brendan Nyhan et Jason Reifler, « Does correcting myths about the flu vaccine work? An experimental evaluation of the effects of corrective information », Vaccine, vol. 33, , p. 459-464 (ISSN 0264-410X).
- (en) Brendan Nyhan et al., « Effective messages in vaccine promotion: a randomized trial », Pediatrics, vol. 133, , e835-e842 (ISSN 1098-4275).
- (en) Margaret Chan, « Progress in public health during the previousdecade and major challenges ahead »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), (consulté le ).
- (en) Jana Fromm (publié dans EFI The Economic ResearchInstitute), Risk denial and neglect studies in risk perception (thèse de doctorat en Philosophie), Stockholm, , 160 p., pdf (lire en ligne).
- (en) Neil Ferguson, « Capturing human behaviour », Nature, vol. 446, , p. 733 (ISSN 0028-0836).
- (en) Katharina Hauck, « The Economics of Infectious Diseases », sur Oxford Research Encyclopedia, Economics and Finance, (consulté le ).
- (en) Juliette Seban et al., « Possession of bed nets in Haut-Katanga (DRC): Prevalence-elastic behaviour or performance of health care system delivery? », Health & Place, vol. 24, , p. 275-285 (ISSN 1353-8292).
- (en) Hélène Joffe, « Public apprehension of emerging infectious diseases: are changes afoot? », Public Understanding of Science, vol. 20, , p. 446-460 (ISSN 0963-6625).
- (en) Jocelyn Raude et al., « Understanding health behaviour changes in response to outbreaks: findings from a longitudinal study of a large epidemic of mosquito-borne disease », Social Science & Medicine, vol. 230, , p. 184-193 (ISSN 0277-9536).








